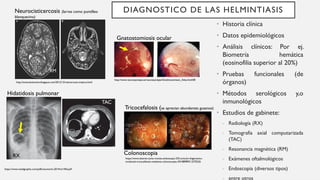
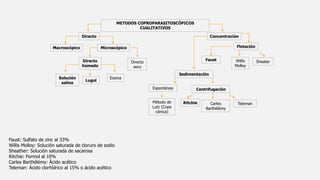
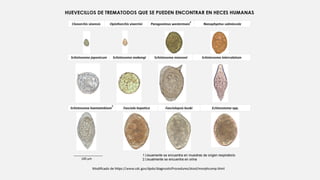
Este documento describe varios métodos para el diagnóstico de helmintiasis, incluyendo métodos directos e indirectos. Los métodos directos detectan al parásito a través de exámenes en fresco, estudios coproparasitoscopicos, cultivos o detección de antígenos. Los métodos indirectos detectan lesiones o respuestas en el huésped. Se detallan diversos métodos coproparasitoscopicos cualitativos y cuantitativos, así como otros métodos como pruebas serológicas, estudios de gabinete e histopat