Estado gaseoso
- 2. GASES La tierra está rodeada por una mezcla de gases que se denomina atmósfera, cuya composición es la siguiente: Nitrógeno 78 % Oxígeno 21% Otros gases 1%
- 3. GASES Etimología Latina: “Chaos”, caos. Estado de la materia que se caracteriza por su gran fluidez, compresibilidad y expansibilidad. No posee volumen constante ni forma definida Materia que llena un recipiente completamente a una densidad uniforme. Van Helmont (1577-1644): “... espíritus desconocidos al quemar madera ...”
- 4. La atmósfera también almacena otros gases… Vapor de agua (H2O) Ozono (O3 ) Dióxido de carbono (CO2) Clorofluorohidrocarbonos (CFC) Dióxido de azufre (SO2) Óxido nítrico Gases nobles El exceso de algunos de ellos genera contaminación atmosférica, como: el calentamiento global , lluvia ácida y la degradación de la capa de ozono (O3).
- 6. ¡Un gas se comporta diferente respecto a los sólidos y líquidos! Sus partículas presentan grandes distancias entre sí. Nula cohesión entre sus moléculas Carece de forma y volumen definido Llena totalmente el recipiente que lo contiene Puede comprimirse Es menos denso que sólidos y líquidos
- 7. Teoría cinética de los gases Los gases están formados por un gran número de átomos o moléculas. Las fuerzas de repulsión molecular son elevadas y las de cohesión nulas. Las partículas de gas se mueven caóticamente, con gran rapidez y chocan entre si y también con las paredes del recipiente que las contiene, provocando presión.
- 8. Al estudiar un gas se relacionan tres variables: Presión Volumen Temperatura P V T
- 9. Presión Resultado de una fuerza que se crea cuando las partículas del gas chocan contra las paredes del recipiente. 1atm = 760 mmHg 1atm = 1. 013 x105 Pa La unidad principal se llama Pascal (Pa). También puede medirse en atmósferas (atm), milímetros de mercurio (mm Hg).
- 10. Volumen El gas llena completamente el recipiente que lo contiene, por lo tanto el volumen será igual al volumen del recipiente. Se mide en: Metros cúbicos (m3), Centímetros cúbicos (cm3) Litros (L) Mililitros (mL).
- 11. Temperatura Siempre se emplea la escala de temperatura absoluta o Kelvin (K). Si un gas alcanza la temperatura del cero absoluto (0 K = -273.15 °C) sus partículas carecerán de movimiento, es decir, de energía cinética (Ec).
- 12. LEY DE LOS GASES IDEALES
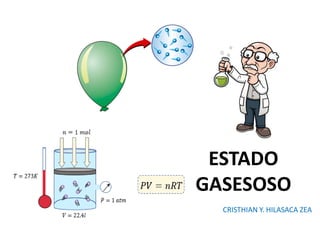
- 13. Gases ideales Son aquellos en los que consideramos que una molécula no ejerce interacción con otra. Que al chocar las moléculas, las colisiones son perfectamente elásticas, es decir no hay pérdida de energía en forma de calor. En su fórmula se considera el número de moles (n), de dicho gas y además la constante universal (R = 0.082 atm*L/mol*K). Su fórmula es: PP**V = n * R * T
- 14. Ley de Boyle¿Qué sucede con la presión de una bomba para inflar llantas, cuando empujamos hacia abajo?
- 15. Ley de Boyle Cuando empujamos hacia abajo… El aire se comprime y aumenta la presión, disminuyendo la distancia entre partículas y observándose una disminución de volumen. Es una relación entre presión y volumen inversamente proporcional. P1V1= P2V2
- 16. Ley de Boyle “A temperatura constante, el volumen de un gas es inversamente proporcional a la presión ” Al aumentar la presión del gas, disminuye su volumen y viceversa.
- 23. Ley de Charles Al preparar un globo aerostático para volar, el aire en el globo se calienta con un pequeños quemador de propano. A medida que el aire se calienta, su volumen se expande y por menor densidad del gas, el globo se eleva
- 24. Ley de Charles Enuncia lo siguiente… “A presión constante, el volumen de un gas es directamente proporcional a su temperatura absoluta”. V1/ T1= V2/T2 Si aumenta la temperatura de un gas, aumenta la energía cinética de las moléculas o átomos de ese gas, para mantener una presión constante, el volumen deberá aumentar, es decir que aumente la distancia entre átomos y moléculas.
- 25. K
- 31. Ley de Gay - Lussac ¿Por qué son más rápidas las ollas exprés en la cocción de los alimentos?
- 32. Ley de Gay - Lussac Una olla exprés es más rápida porque… El volumen de una olla no cambia, al incrementarse la temperatura y no dejar escapar su vapor, aumenta la presión y chocan con mayor frecuencia los átomos y moléculas del gas contenido en ella, esto hace que la cocción se más rápida. Relaciona directamente a la presión (P) con la temperatura (T). P1/ T1= P2/ T2
- 38. P V T Ley de Boyle Ley de CharlesLey de Gay - Lussac P1V1 = P2V2 V1/T1 = V2 /T2P1/T1 = P2/T2 P1V1 = P2V2 T1 T2 LLeeyyGGeenneerraallddeeloloss ggaasseess Inversamente proporcional Directamente proporcionalDirectamente proporcional
- 39. •LEY COMBINADA DE LOS GASES (LEY DE BOYLE Y DE CHARLES Relaciona el volumen de una cantidad fija de un gas con la presión y la temperatura, cuando estas propiedades varían simultáneamente. P1V1T2 = P2V2T1
- 65. V= 162.62 L.
