Clase 1
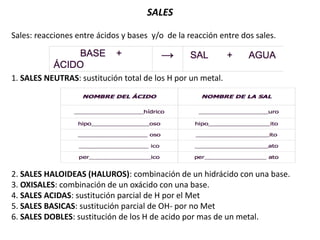
- 1. SALES Sales: reacciones entre ácidos y bases y/o de la reacción entre dos sales. 1. SALES NEUTRAS: sustitución total de los H por un metal. 2. SALES HALOIDEAS (HALUROS): combinación de un hidrácido con una base. 3. OXISALES: combinación de un oxácido con una base. 4. SALES ACIDAS: sustitución parcial de H por el Met 5. SALES BASICAS: sustitución parcial de OH- por no Met 6. SALES DOBLES: sustitución de los H de acido por mas de un metal.
- 2. SALES EN DISOLUCION • Sales hidrolizables: provienen de a.f. + b.d. / a.d. + b.f. • Hidrólisis: reacción de sal con agua, dando origen a una solución alcalina o acida. • Kh: constante de equilibrio de hidrólisis Procesos de hidrólisis / solvolisis: 1. Sal de a.f + b.f , su pH = neutro 2. Sal de a.d. + b.f. , su pH = básico 3. Sal de a.f. + b.d., su pH = acido 4. Sal a.d.+ b.d. , su pH depende de la relación Ka/Kb : si Ka > Kb, pH < 7 si Ka = Kb, pH = 7 si Ka< Kb, pH > 7
- 3. CALCULO DE pH DE SALES 1. pH = ½ pKw + ½ pKa + ½ log C (a.d. con b.f) Kw Kh = ---------- = √ Kw /Ka x C Ka 2. pH = ½ pKw - ½ pKb - ½ log C (a.f con b.d.) Kw Kh = -------------- = √ Kw / Kb x C Kb 3. pH = ½ pKw + ½ pKa - ½ pKb (a.d. y b.d.) Kw Kh = -------------- Ka o Kb SOLUCIONES AMORTIGUADORA (reguladora / tampón): mantiene el pH aprox. constante CONSTITUCION: Tipo I : acido débil + sal de su base conjugada (reguladoras acidas) Tipo II: base débil + sal de su acido conjugado (reguladoras básicas)
- 4. SOLUBILIDAD EN AGUA 1. SOLUBLES: 2. INSOLUBLES:
- 5. REACCIONES DE PRECIPITACION *Equilibrios químicos: heterogéneos Formación: - producto insoluble formado con iones - sobrepaso de saturación Solubilidad (S) : máx. cantidad de soluto (formación de solución saturada), (moles/L): - Molar - Relativa Sol. saturada: el soluto no se disuelve mas en el solvente Factores influyentes en S: • Directos: 1) Tº S 2) Efecto salino ( S ) 3) Efecto del ion común ( S ) • Indirectos: productos de solubilidad condicional
- 6. PRECIPITADOS Producto de solubilidad : la constante de equilibrio heterogéneo. En general: MxAy xMy+ + yAx- My+ Ax- S = -------- = --------- My+ = xS y Ax- = yS x y Ks (Kps) : mas pequeño, mas fácil se precipita. Indica la fracción disociada PI : concentracion de c/ion en un instante determinado. Condiciones de precipitación: PI > Kps hay precipitación PI = Kps disolución saturada (equilibrio) PI < Kps no precipita
- 8. PRECIPITACION • COMPLETA : conc. de ion disminuye a 10 -5 M 1. A igualdad de conc. se precipita 1º, el que tiene menor Kps 2. Se precipita antes la sal, que tiene conc. alta de sus iones . 3. El pH del medio (hidróxidos y sales de a / b débiles) Precipitados de HIDROXIDOS: - conc. de iones OH- - mayor pH Precipitados de SALES DE A.D.: - valor del pH bajo - valor Kps (mas bajo, mas se precipita en pH ácidos) Precipitados de SALES DE A.F.: - no hay influencia del pH - exceso tiene efecto salino ( S )
- 9. PRECIPITACION FRACCIONADA: Reglas: • El primero se precipita el ion cuya Kps es menor • Precipitara antes la sal donde la concentración de sus iones esta en abundancia. • no empieza precipitar el 2do ion antes que la conc. del 1ero se haya reducido a 1/10 2 parte de su C inicial EJEMPLO: • Cl- + Br- + Ag+ AgCl (s) + AgBr (s) Kps (AgCl) = 1,82 x 10 -10 Kps (AgBr) = 7,7 x 10 -15
- 10. SOLUBILIDAD DE PRECIPITADOS • En general depende de 2 factores: - Fuerza de atracción eléctrica; - Efecto de hidratación; • Disminución de las concentraciones de uno de los iones (S ): 1. Formación de un a.d.: precipitados con aniones aportados por a.d. se disuelven en a.f. 2. Formación de una b.d.: eliminar concentración de iones de OH 3. Formación de un complejo estable: K inest > Kps 4. Mediante un proceso redox: cambio de numero de oxidación.
- 11. TRANSFORMACIONDE UN COMPUESTO POCO SOLUBLE • 2 caminos de transformación: a) Insoluble: Ag2CrO4 AgCl Kps(Ag2CrO4) = 1,1x10-12 Kps(AgCl) = 1,1 x 10-10 b) menos soluble: BaSO4 BaCO3 Kps(BaSO4) = 1,1 x 10 -10 Kps(BaCO3) = 5,1 x 10-9
