Espectrofotometría UV-Vis
- 1. QUÍMICA ANALÍTICA Y ANÁLISIS INSTRUMENTAL SESIÓN 10: Métodos espectrofotométricos Mg. Ing. Javier Chumán López
- 2. Al término de la sesión, el estudiante comprende y aplica las LEY DE BEER LAMBERT en soluciones coloreadas.
- 3. Es una técnica analítica utilizada para medir cuánta luz absorbe una sustancia química, midiendo la intensidad de la luz cuando un haz luminoso pasa a través de la solución muestra ESPECTROFOTOMETRÍA
- 4. TEORÍA ELECTROMAGNÉTICA La radiación electromagnética es considerada como paquetes discretos de energía llamados fotones o cuantos. Dualidad onda-partícula: Un fotón es una partícula de radiación electromagnética con masa cero y energía E proporcional a la frecuencia de la radiación ϑ La energía de un fotón: E = h ϑ •E = energía del cuanto de radiación: Cal mol-1 •ϑ = frecuencia de la radiación : hertzio (Hz) = ciclos s-1 •h = constante de Planck = 6,624 • 10-27 erg s Velocidad de la luz : v = ϑ λ Velocidad de la luz en el vacío: c = 3,00 • 1010 cm s-1 Energía de un fotón :E = h ϑ = h c /λ ➢Cuando λ aumenta, disminuye la energía y frecuencia del fotón Teoría corpuscular. Propiedades corpusculares de la radiación electromagnética
- 5. ESPECTRO ELECTROMAGNÉTICO • Abarca un intervalo muy amplio de longitudes de onda o energías. • Según su λ recibe diferentes nombres. • La luz visible, que es la única perceptible por el ojo humano, representa solamente una pequeña parte del espectro, desde 350-380 a 750-780 nm.
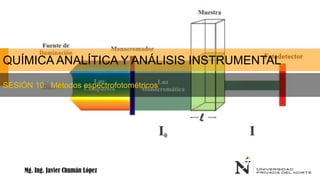
- 6. FUNDAMENTO DE LA ESPECTROFOTOMETRÍA DE ABSORCIÓN UV-VISIBLE ➢Método instrumental óptico basado en la medida directa de la absorción de radiación electromagnética UV-Visible, por las moléculas del analito contenido en la muestra. • La región ultravioleta comprende entre 10 y 400 nm y la región visible comprende entre 350 y 750 nm.
- 7. FUNDAMENTO DE LA ESPECTROFOTOMETRÍA DE ABSORCIÓN UV-VISIBLE
- 8. FUNDAMENTO DE LA ESPECTROFOTOMETRÍA DE ABSORCIÓN UV-VISIBLE
- 9. FUNDAMENTO DE LA ESPECTROFOTOMETRÍA DE ABSORCIÓN UV-VISIBLE
- 10. TEORÍA DEL COLOR • La sensación de color se produce cuando disminuye apreciablemente una o más zonas de la región visible. • Si el ojo recibe luz de todas las λ de la región visible el efecto es luz blanca. • El color aparente siempre es el color complementario del que ha sido eliminado. • Los colores complementarios son útiles para predecir la λ de absorción de los compuestos coloreados: una disolución amarilla, absorberá luz azul 450-480 nm, para analizarla debemos usar luz con esta λ seleccionada con el monocromador o bien usar un filtro azul, que transmite esta luz azul
- 11. TEORÍA DEL COLOR amarillo-verde 520 - 550 violeta 380 - 420 amarillo 550 - 580 420 - 440 anaranjado 580 - 620 azul 440 - 470 rojo 620 - 680 verde-azul 470 - 500 púrpura 680 - 780 verde 500 - 520 verde 500 - 520 púrpura 680 - 780 verde-azul 470 - 500 rojo 620 - 680 azul 440 - 470 anaranjado 580 - 620 azul-violeta 420 - 440 amarillo 550 - 580 violeta 380-420 amarillo-verde 520 - 550 Color absorbido λ (nm) complementario Color observado λ (nm) Una disolución se observa de color azul cuando se ilumina con luz policromática, porque absorbe λ azul-violeta
- 12. Absorción de compuestos orgánicos
- 13. Absorción de compuestos orgánicos Cromoforos: sustancia que tiene electrones capaces de absorber energía y excitarse, a diferentes longitudes de onda.
- 14. Espectros de absorción de compuestos orgánicos
- 16. Solventes
- 19. ¿Cómo cuantificar especies no absorbentes? Muchos analitos no absorbentes se determinan mediante fotometría al hacer que reaccionen con agentes cromóforos para obtener productos que absorben en las regiones ultravioleta y visible. El ion tiocianato para el hierro, cobalto y molibdeno; el anión del peróxido de hidrógeno para el titanio, vanadio y cromo. y el ion yoduro para el bismuto, paladio y telurio.
- 20. También se aplican quelantes orgánicos, que forman complejos coloreados estables con los cationes: ¿Cómo cuantificar especies no absorbentes?
- 21. FUNDAMENTO DE LA ESPECTROFOTOMETRÍA DE ABSORCIÓN UV-VISIBLE Especie absorbente Sus electrones más exteriores o electrones de enlace pueden ser elevados a niveles de E más altos al incidir sobre ellas una radiación electromagnética apropiada Grupo cromóforo • Grupo atómico presente en una molécula que lleva asociada una banda de absorción electromagnética: C=C; C=O; C=N. • Especies con grupos funcionales con enlaces π. • Grupos cromóforos →dobles y triples enlaces. • Bandas en el UV cercano y visible. • Etileno, carbonilo, éster, amida, nitro… Grupo auxocromo Grupos que no producen por sí mismos bandas de absorción, pero intensifican la de los grupos cromóforos: C-Br; C-OH Responsables del color de muchos iones y compuestos de metales de transición que poseen orbitales d y f Bandas de campo ligando 21
- 22. LEY DE BEER & LAMBERT Establece que la absorbancia es proporcional al número de moléculas absorbentes.
- 23. LEY DE BEER & LAMBERT T = 25% A = -LOG (0.25) A =0.602
- 26. -Disoluciones que contienen varias especies absorbentes: Para cada λ: Atotal =∑Ai = A1 + A2 + .... + An Como A = · b · c A = 1 · b · c1 + 2 · b · c2 + …. +n · b · cn Siendo 1, 2, …, n los componentes absorbentes.
- 27. DESVIACIÓN DE LA LEY DE BEER
- 28. Taller #8 Resolver los ejercicios de Lambert