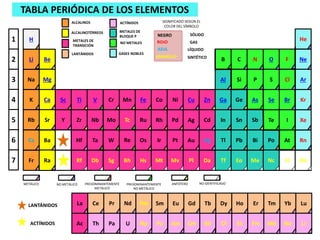
Tabla Periódica Electrónica
- 1. Cs Ba IrOsHf ReTa W Pt Au RnAtTlHg PoPb Bi PuNpAc UTh Pa Am Cm LrNoCfBk MdEs Fm SmPmLa NdCe Pr Gd LuYbDyTb TmHo Er Fr MtHsRf BhDb Sg Mv OnElTfDa NcEo Me CoFeTiSc MnV Cr Ni Cu KrBrGaZn SeGe AsCa RhRuZrY TcNb Mo Pd Ag XeIInCd Sn Sb Na Mg Li Be H ArClAl SSi P NeFB OC N He1 2 3 4 5 6 7 Eu Pl Sr K Rb Te Ra METÁLICO NO METÁLICO PREDOMINANTEMENTE METÁLICO PREDOMINANTEMENTE NO METÁLICO ANFÓTERO NO IDENTIFICADO SIGNIFICADO SEGÚN EL COLOR DEL SÍMBOLO NEGRO ROJO AZUL AMARILLO SÓLIDO GAS LÍQUIDO SINTÉTICO GASES NOBLES TABLA PERIÓDICA DE LOS ELEMENTOS ALCALINOS ALCALINOTÉRREOS METALES DE TRANSICIÓN LANTÁNIDOS ACTÍNIDOS METALES DE BLOQUE P NO METALES LANTÁNIDOS ACTÍNIDOS
- 2. Nombre Hidrógeno Número atómico 1 Valencia 1 Estado de oxidación +1 Electronegatividad 2,1 Radio covalente (Å) 0,37 Radio iónico (Å) 2,08 Radio atómico (Å) - Configuración electrónica 1s1 Primer potencial de ionización (eV) 13,65 Masa atómica (g/mol) 1,00797 Densidad (g/ml) 0,071 Punto de ebullición (ºC) -252,7 Punto de fusión (ºC) -259,2 Descubridor Boyle en 1671 Usos: El empleo más importante del hidrógeno es en la síntesis del amoniaco. La utilización del hidrógeno está aumentando con rapidez en las operaciones de refinación del petróleo, como el rompimiento por hidrógeno, y en el tratamiento con hidrógeno para eliminar azufre. Se consumen grandes cantidades de hidrógeno en la hidrogenación catalítica de aceites vegetales líquidos insaturados para obtener grasas sólidas. La hidrogenación se utiliza en la manufactura de productos químicos orgánicos. Grandes cantidades de hidrógeno se emplean como combustible de cohetes, en combinación con oxígeno o flúor, y como un propulsor de cohetes impulsados por energía nuclear. Efectos de la exposición al hidrógeno: Fuego: Extremadamente inflamable. Muchas reacciones pueden causar fuego o explosión. Explosión: La mezcla del gas con el aire es explosiva. Vías de exposición: La sustancia puede ser absorbida por el cuerpo por inhalación. Inhalación: Altas concentraciones de este gas pueden causar un ambiente deficiente de oxígeno. Los individuos que respiran esta atmósfera pueden experimentar síntomas que incluyen dolores de cabeza, pitidos en los oídos, mareos, somnolencia, inconsciencia, náuseas, vómitos y depresión de todos los sentidos. La piel de una víctima puede presentar una coloración azul. Bajo algunas circunstancias se puede producir la muerte. No se supone que el hidrógeno cause mutagénesis, embriotoxicidad, teratogenicidad o toxicidad reproductiva. Las enfermedades respiratorias preexistentes pueden ser agravadas por la sobreexposición al hidrógeno. Riesgo de inhalación: Si se producen pérdidas en su contenedor, se alcanza rápidamente una concentración peligrosa. Peligros físicos: El gas se mezcla bien con el aire, se forman fácilmente mezclas explosivas. El gas es más ligero que el aire. Peligros químicos: El calentamiento puede provocar combustión violenta o explosión. Reacciona violentamente con el aire, oxígeno, halógenos y oxidantes fuertes provocando riesgo de incendio y explosión. Los catalizadores metálicos, tales como platino y níquel, aumentan enormemente estas reacciones. Efecto sobre plantas o animales: Cualquier efecto en animales será debido a los ambientes deficientes de oxígeno. No se anticipa que tenga efectos adversos sobre las plantas, aparte de la helada producida en presencia de los gases de expansión rápida. Efecto sobre la vida acuática: Actualmente no se dispone de evidencia sobre el efecto del hidrógeno en la vida acuática. Efectos ambientales del Hidrógeno Efectos del Hidrógeno sobre la salud
- 3. Nombre Helio Número atómico 2 Valencia 0 Estado de oxidación - Electronegatividad - Radio covalente (Å) 0,93 Radio iónico (Å) - Radio atómico (Å) - Configuración electrónica 1s2 Primer potencial de ionización (eV) 24,73 Masa atómica (g/mol) 4,0026 Densidad (g/ml) 0,126 Punto de ebullición (ºC) -268,9 Punto de fusión (ºC) -269,7 Descubridor Sir Ramsey en 1895 El helio es un gas incoloro, inodoro e insípido. Tiene menor solubilidad en agua que cualquier otro gas. Es el elemento menos reactivo y esencialmente no forma compuesto químicos. La densidad y la viscosidad del vapor de helio son muy bajas. La conductividad térmica y el contenido calórico son excepcionalmente altos. El helio puede licuarse, pero su temperatura de condensación es la más baja de cualquier sustancia conocida. El helio fue el primer gas de llenado de globos y dirigibles. Esta aplicación continúa en la investigación de alta altitud y para globos meteorológicos. El uso principal del helio lo constituye el gas inerte de protección en soldadura autógena. Su mayor potencial lo encontramos en aplicaciones a temperaturas muy bajas. El helio es el único refrigerante capaz de alcanzar temperaturas menores que 14 K (- 434ºF). El principal valor de la temperatura ultra baja está en el desarrollo del estado de superconductividad, en el cual hay prácticamente una resistencia cero al flujo de la electricidad. Otras aplicaciones son su uso como gas presurizarte en combustibles líquidos de cohetes, en mezclas helio-oxígeno para buzos, como fluido de trabajo en los reactores nucleares enfriados por gas y como gas transportador en los análisis químicos por cromatografía de gases. Efectos del Helio sobre la salud Efectos de la exposición: La sustancia puede ser absorbida por el cuerpo por inhalación. Inhalación: Elevación de la voz. Mareos. Pesadez. Dolor de cabeza. Asfixia. Piel: Congelación en contacto con el líquido. Riesgo de inhalación: Si hay pérdidas en el contenedor este gas puede provocar asfixia, ya que hace disminuir el contenido de oxígeno en el aire en los lugares cerrados. Comprobar la concentración de oxígeno antes de entrar en el recinto.
- 4. Nombre Litio Número atómico 3 Valencia 1 Estado de oxidación +1 Electronegatividad 1,0 Radio covalente (Å) 1,34 Radio iónico (Å) 0,60 Radio atómico (Å) 1,55 Configuración electrónica 1s22s1 Primer potencial de ionización (eV) 5,41 Masa atómica (g/mol) 6,941 Densidad (g/ml) 0,53 Punto de ebullición (ºC) 1330 Punto de fusión (ºC) 180,5 Descubridor George Urbain en 1907 El principal uso industrial del litio es en forma de estearato de litio como espesante para grasas lubricantes. Otras aplicaciones importantes de compuestos de litio son en cerámica, de modo específico en la formulación de esmaltes para porcelana; como aditivo para alargar la vida y el rendimiento en acumuladores alcalinos y en soldadura autógena y soldadura para latón. El litio es un elemento moderadamente abundante y está presente en la corteza terrestre en 65 partes por millón(ppm). Esto lo coloca por debajo del níquel, cobre y tungsteno y por encima del cerio y estaño, en lo referente a abundancia. Entre las propiedades físicas más notables del litio están el alto calor específico (capacidad calorifica), el gran intervalo de temperatura de la fase líquida, alta conductividad térmica, baja viscosidad y muy baja densidad. El litio metálico es soluble en aminas alifáticas de cadena corta, como la etilamina. Es insoluble en los hidrocarburos. Efectos del Litio sobre la salud Efectos de la exposición al litio: Fuego: Inflamable. Muchas reacciones pueden causar fuego o explosión. Libera vapores (o gases) irritantes y tóxicos en un incendio. Explosión: Riesgo de incendio y explosión en contacto con sustancias combustibles y agua. Inhalación: Sensación de quemadura. Tos. Respiración trabajosa. Falta de aire. Dolor de garganta. Los síntomas pueden ser retrasados. Piel: Enrojecimiento. Quemaduras cutáneas. Dolor. Ampollas. Ojos: Enrojecimiento. Dolor. Quemaduras severas y profundas. Ingestión: Calambres abdominales. Dolor abdominal. Sensación de quemadura. Náuseas. Shock o colapso. Vómitos. Debilidad. Vías de exposición: La sustancia puede ser absorbida por el cuerpo por inhalación de su aerosol y por ingestión. Riesgo de inhalación: La evaporación a 20°C es insignificante; sin embargo cuando se dispersa se puede alcanzar rápidamente una concentración peligrosa de partículas suspendidas en el aire. Efectos de la exposición a corto plazo: La sustancia es corrosiva para los ojos, la piel y el tracto respiratorio. Corrosivo si es ingerido. La inhalación de la sustancia puede causar edema pulmonar. Normalmente los síntomas del edema pulmonar no se manifiestan hasta después de unas horas y son agravados por el esfuerzo físico. El reposo y la observación médica son por lo tanto esenciales. Debe ser considerada la administración inmediata de un spray apropiado, por un médico o una persona autorizada por él. Efectos ambientales del Litio El litio metálico reacciona con el nitrógeno, el oxígeno, y el vapor de agua en el aire. Consecuentemente, la superficie del litio se recubre de una mezcla de hidróxido de litio (LiOH), carbonato de litio (Li2CO3), y nitrato de litio (Li3N). El hidróxido de litio representa un peligro potencialmente significativo porque es extremadamente corrosivo. Se debe prestar especial atención a los organismos acuáticos.
- 5. Nombre Berilio Número atómico 4 Valencia 2 Estado de oxidación +2 Electronegatividad 1,5 Radio covalente (Å) 0,90 Radio iónico (Å) 0,31 Radio atómico (Å) 1,12 Configuración electrónica 1s22s2 Primer potencial de ionización (eV) 9,38 Masa atómica (g/mol) 9,0122 Densidad (g/ml) 1,85 Punto de ebullición (ºC) 2770 Punto de fusión (ºC) 1277 Descubridor Fredrich Wohler El principal uso del berilio metálico se encuentra en la manufactura de aleaciones berilio-cobre y en el desarrollo de materiales moderadores y reflejantes para reactores nucleares. La adición de un 2% de berilio al cobre forma una aleación no magnética seis veces más fuerte que el cobre. Estas aleaciones berilio-cobre tienen numerosas aplicaciones en la industria de herramientas ya que no producen chispas, en las partes móviles críticas de aviones, así como en componentes clave de instrumentos de precisión, computadoras mecánicas, reveladores eléctricos y obturadores de cámaras fotográficas. Martillos, llaves y otras herramientas de berilio-cobre se emplean en refinerías petroleras y otras plantas en las cuales una chispa producida por piezas de acero puede ocasionar una explosión o un incendio. Efectos del Berilio sobre la salud El berilio no es un elemento crucial para los humanos: en realidad es uno de los más tóxicos que se conocen. Es un metal que puede ser muy perjudicial cuando es respirado por los humanos, porque puede dañar los pulmones y causar neumonía. El efecto más comúnmente conocido del berilio es la llamada beriliosis, una peligrosa y persistente enfermedad de los pulmones que puede incluso dañar otros órganos, como el corazón. Alrededor del 20% de todos los casos de beriliosis terminan con la muerte del enfermo. La causa de la beriliosis es la respiración de berilio en el lugar de trabajo. Las personas con el sistema inmune debilitado son más sucesibles a esta enfermedad. Efectos ambientales del Berilio El berilio entra en el aire, agua y suelo como resultado de procesos naturales y actividades humanas. Esto ocurre de forma natural en el medio ambiente en pequeñas cantidades. El hombre añade berilio a través de la producción de metal y de la combustión de carbón y aceite. El berilio existe en el aire en pequeñas partículas de polvo. Entra en el agua durante los procesos de desintegración de suelos y rocas. Las emisiones industriales añaden berilio al aire y al agua residual y éstas serán posteriormente traspasadas al agua. Normalmente precipita en el sedimento. El berilio como elemento químico está presente en los suelos en pequeñas cantidades de forma natural, pero las actividades humanas han incrementado esos niveles de berilio. Es probable que el berilio no se mueva hacia la zona profunda del suelo y no entre en contacto con el agua subterránea.
- 6. El boro y sus compuestos tienen muchas aplicaciones en diversos campos, aunque el boro elemental se emplea principalmente en la industria metalúrgica. Su gran reactividad a temperaturas altas, en particular con oxígeno y nitrógeno, lo hace útil como agente metalúrgico degasificante. Se utiliza para refinar el aluminio y facilitar el tratamiento térmico del hierro maleable. El boro incrementa de manera considerable la resistencia a alta temperatura, característica de las aleaciones de acero. El boro elemental se emplea en reactores atómicos y en tecnologías de alta temperatura. Las propiedades físicas que lo hacen atractivo en la construcción de misiles y tecnología de cohetes son su densidad baja, extrema dureza, alto punto de fusión y notable fuerza tensora en forma de filamentos. Cuando las fibras de boro se utilizan en material portador o matriz de tipo epoxi (u otro plástico), la composición resultante es más fuerte y rígida que el acero y 25% más ligera que el aluminio. El bórax, Na2B4O710H2O, refinado es un ingrediente importante en ciertas variedades de detergentes, jabones, ablandadores de agua, almidones para planchado, adhesivos, preparaciones para baño, cosméticos. Talcos y papel encerado. Se utiliza también en retardantes a la flama, desinfectantes de frutas y madera, control de hierbas e insecticidas, así como en la manufactura de papel, cuero y plásticos. Nombre Boro Número atómico 5 Valencia 3 Estado de oxidación +3 Electronegatividad 2,0 Radio covalente (Å) 0,82 Radio iónico (Å) 0,20 Radio atómico (Å) 0,98 Configuración electrónica 1s22s22p1 Primer potencial de ionización (eV) 8,33 Masa atómica (g/mol) 10,811 Densidad (g/ml) 2,34 Punto de ebullición (ºC) - Punto de fusión (ºC) 2030 Descubridores Sir Humphry Davy y J.L Gay-Lussac en 1808 Efectos del Boro sobre la salud El Boro ocurre de forma natual en el medioambiente debido a que es liberado al aire, suelo y agua a través de los procesos de erosión. Este puede también aparecer en el agua subterránea en muy pequeñas cantidades. Los humanos utilizan Boro en las industrias del vidrio pero la liberación de Boro por los humanos es más pequeña que las concentraciones liberadas por procesos naturales de erosión. Las plantas absorben Boro del suelo y a través del consumo de plantas por los animales este termina en las cadena alimentarias. El Boro ha sido encontrado en los tejidos animales pero este no parece ser que se acumule. Cuando los animales absorben grandes cantidades de Boro en un periodo de tiempo corto a través de la comida o el agua los órganos reproductivos masculinos serán afectados. Cuando los animales son expuestos al Boro durante el embarazo sus descencientes pueden sufrir defectos de nacimiento y fallos en el desarrollo. Además, los animales sufren irritación de nariz cuando respiran Boro. Efectos ambientales del Boro Los humanos pueden ser expuestos al Boro a través de las frutas y vegetales, el agua, aire y el consumo de productos. Comer peces o carne no incrementará la concentración de Boro en nuestros cuerpos, el Boro no se acumula en los tejidos animales. La exposición al Boro a través del aire y del agua no es muy frecuente que ocurra, pero el riesgo de exposición al polvo de Boro en el lugar de trabajo existe.
- 7. Nombre Carbono Número atómico 6 Valencia 2,+4,-4 Estado de oxidación +4 Electronegatividad 2,5 Radio covalente (Å) 0,77 Radio iónico (Å) 0,15 Radio atómico (Å) 0,914 Configuración electrónica 1s22s22p2 Primer potencial de ionización (eV) 11,34 Masa atómica (g/mol) 12,01115 Densidad (g/ml) 2,26 Punto de ebullición (ºC) 4830 Punto de fusión (ºC) 3727 Descubridor Los antiguos El carbono elemental existe en dos formas alotrópicas cristalinas bien definidas: diamante y grafito. Otras formas con poca cristalinidad son carbón vegetal, coque y negro de humo. El carbono químicamente puro se prepara por descomposición térmica del azúcar (sacarosa) en ausencia de aire. Las propiedades físicas y químicas del carbono dependen de la estructura cristalina del elemento. La densidad fluctúa entre 2.25 g/cm³ (1.30 onzas/in³) para el grafito y 3.51 g/cm³ (2.03 onzas/in³) para el diamante. El punto de fusión del grafito es de 3500ºC (6332ºF) y el de ebullición extrapolado es de 4830ºC (8726ºF). El carbono elemental es una sustancia inerte, insoluble en agua, ácidos y bases diluidos, así como disolventes orgánicos. A temperaturas elevadas se combina con el oxígeno para formar monóxido o dióxido de carbono. Con agentes oxidantes calientes, como ácido nítrico y nitrato de potasio, se obtiene ácido mielítico C6(CO2H)6. De los halógenos sólo el flúor reacciona con el carbono elemental. Un gran número de metales se combinan con el elemento a temperaturas elevadas para formar carburos. Efectos del Carbono sobre la salud El carbono elemental es de una toxicidad muy baja. Los datos presentados aquí de peligros para la salud están basados en la exposición al negro de carbono, no carbono elemental. La inhalación continuada de negro de carbón puede resultar en daños temporales o permanentes a los pulmones y el corazón. Se ha encontrado neumoconiosis en trabajadores relacionados con la producción de negro de carbón. También se ha dado parte de afecciones cutáneas tales como inflamación de los folículos pilosos, y lesiones de la mucosa bucal debidos a la exposición cutánea. Carcinogenicidad: El negro de carbón ha sido incluido en la lista de la Agencia Internacional de Investigación del Cáncer (AIIC) dentro del grupo 3 (agente no clasificable con respecto a su carcinogenicidad en humanos). Efectos ambientales del Carbono No se tiene constancia de que el carbono tenga efectos negativos sobre el medio ambiente.
- 8. Nombre Nitrógeno Número atómico 7 Valencia 1,2,+3,- 3,4,5 Estado de oxidación - 3 Electronegatividad 3,0 Radio covalente (Å) 0,75 Radio iónico (Å) 1,71 Radio atómico (Å) 0,92 Configuración electrónica 1s22s22p3 Primer potencial de ionización (eV) 14,66 Masa atómica (g/mol) 14,0067 Densidad (g/ml) 0,81 Punto de ebullición (ºC) -195,79 ºC Punto de fusión (ºC) -218,8 Descubridor Rutherfor d en 1772 Elemento químico, símbolo N, número atómico 7, peso atómico 14.0067; es un gas en condiciones normales. El nitrógeno molecular es el principal constituyente de la atmósfera ( 78% por volumen de aire seco). Esta concentración es resultado del balance entre la fijación del nitrógeno atmosférico por acción bacteriana, eléctrica (relámpagos) y química (industrial) y su liberación a través de la descomposición de materias orgánicas por bacterias o por combustión. En estado combinado, el nitrógeno se presenta en diversas formas. Es constituyente de todas las proteínas (vegetales y animales), así como también de muchos materiales orgánicos. Su principal fuente mineral es el nitrato de sodio. Gran parte del interés industrial en el nitrógeno se debe a la importancia de los compuestos nitrogenados en la agricultura y en la industria química; de ahí la importancia de los procesos para convertirlo en otros compuestos. El nitrógeno también se usa para llenar los bulbos de las lámparas incandescentes y cuando se requiere una atmósfera relativamente inerte. Efectos del Nitrógeno sobre la salud Las moléculas de Nitrógeno se encuentran principalmente en el aire. En agua y suelos el Nitrógeno puede ser encontrado en forma de nitratos y nitritos. Todas estas substancias son parte del ciclo del Nitrógeno, aunque hay una conexión entre todos. Los humanos han cambiado radicalmente las proporciones naturales de nitratos y nitritos, mayormente debido a la aplicación de estiércoles que contienen nitrato. El Nitrógeno es emitido extensamente por las industrias, incrementando los suministros de nitratos y nitritos en el suelo y agua como consecuencia de reacciones que tienen lugar en el ciclo del Nitrógeno. Las concentraciones de Nitrógeno en agua potable aumentarán grandemente debido a esto. Nitratos y nitritos son conocidos por causar varios efectos sobre la salud. Estos son los efectos más comunes: •Reacciones con la hemoglobina en la sangre, causando una disminución en la capacidad de transporte de oxígeno por la sangre. (nitrito) •Disminución del funcionamiento de la glándula tiroidea. (nitrato) •Bajo almacenamiento de la vitamina A. (nitrato) •Producción de nitrosaminas, las cuales son conocidas como una de las más común causa de cáncer. (nitratos y nitritos) Efectos ambientales del Nitrógeno Los humanos han cambiado radicalmente los suministros de nitratos y nitritos. La mayor causa de la adición de nitratos y nitritos es el uso intensivo de fertilizantes. Los procesos de combustión pueden también realzar los suministros de nitrato y nitrito, debido a la emisión de óxidos de nitrógeno que puede ser convertidos en nitratos y nitritos en el ambiente.
- 9. Nombre Oxígeno Número atómico 8 Valencia 2 Estado de oxidación - 2 Electronegatividad 3,5 Radio covalente (Å) 0,73 Radio iónico (Å) 1,40 Radio atómico (Å) - Configuración electrónica 1s22s22p4 Primer potencial de ionización (eV) 13,70 Masa atómica (g/mol) 15,9994 Densidad (kg/m3) 1.429 Punto de ebullición (ºC) -183 Punto de fusión (ºC) -218,8 Descubridor Joseph Priestly 1774 Existen equipos capaces de concentrar el oxígeno del aire. Son los llamados generadores o concentradores de oxígeno, que son los utilizados en los bares de oxígeno. El oxígeno gaseoso no combinado suele existir en forma de moléculas diatómicas, O2, pero también existe en forma triatómica, O3, llamada ozono. El oxígeno se separa del aire por licuefacción y destilación fraccionada. Las principales aplicaciones del oxígeno en orden de importancia son: 1) fundición, refinación y fabricación de acero y otros metales; 2) manufactura de productos químicos por oxidación controlada; 3) propulsión de cohetes; 4) apoyo a la vida biológica y medicina, y 5) minería, producción y fabricación de productos de piedra y vidrio. Existen equipos generadores de ozono, los cuales son usados para oxidación de materias, para ozonización de piscinas... Efectos del Oxígeno sobre la salud Todo ser humano necesita oxígeno para respirar, pero como ocurre con mucahs sustancias un exceso de oxígeno no es bueno. Si uno se expone a grandes cantidades de oxígeno durante mucho tiempo, se pueden producir daños en los pulmones. Respirar un 50-100% de oxígeno a presión normal durante un periodo prolongado provoca daños en los pulmones. Las personas que en su trabajo sufren exposiciones frecuentes o potencialmente elevadas a oxígeno puro, deben hacerse un chequeo de funcionamiento pulmonar antes y después de desempeñar ese trabajo. El oxígeno es normalmente almacenado a temperaturas muy bajas y por lo tanto se deben usar ropas especiales para prevenir la congelación de los tejidos corporales. Efectos ambientales del Oxígeno No ha sido constatado ningún efecto negativo del oxígeno en el medio ambiente.
- 10. Nombre Flúor Número atómico 9 Valencia -1 Estado de oxidación -1 Electronegatividad 4,0 Radio covalente (Å) 0,72 Radio iónico (Å) 1,36 Radio atómico (Å) - Configuración electrónica 1s22s22p5 Primer potencial de ionización (eV) 17,54 Masa atómica (g/mol) 18,9984 Densidad (g/ml) 1,11 Punto de ebullición (ºC) -188,2 Punto de fusión (ºC) -219,6 Descubridor Moissan en 1886 Propiedades: El flúor elemental es un gas de color amarillo pálido a temperaturas normales. El olor del elemento es algo que está todavía en duda. La reactividad del elemento es tan grande que reacciona con facilidad, a temperatura ambiente, con muchas otras sustancias elementales, entre ellas el azufre, el yodo, el fósforo, el bromo y la mayor parte de los metales. Dado que los productos de reacción con los no metales son líquidos o gases, las reacciones continúan hasta consumirlo por completo, con frecuencia con producción considerable de calor y luz. En las reacciones con los metales forma un fluoruro metálico protector que bloquea una reacción posterior a menos que la temperatura se eleve. El aluminio, el níquel, el magnesio y el cobre forman tales películas de fluoruro protector. El flúor reacciona con violencia considerable con la mayor parte de los compuestos que contienen hidrógeno, como el agua, el amoniaco y todas las sustancias orgánicas, sean líquidos, sólidos o gases. La reacción del flúor con el agua es compleja y produce principalmente fluoruro de hidrógeno y oxígeno, así como cantidades menores de peróxido de hidrógeno, difluoruro de oxígeno y ozono. El flúor desplaza otros elementos no metálicos de sus compuestos, aun aquellos muy cercanos en cuanto a actividad química. Desplaza el cloro del cloruro de sodio y el oxígeno en la sálica, en vidrio y en algunos materiales cerámicos. En ausencia de fluoruro de hidrógeno, el flúor no ataca en forma significativa al cuarzo o al vidrio, ni aun después de varias horas a temperaturas hasta de 200ºC (390ºF). Efectos del Flúor sobre la salud En el agua, aire, plantas y animales hay presentes pequeñas cantidades de flúor. Como resultado los humanos están expuestos al flúor a través de los alimentos y el agua potable y al respirar el aire. El flúor se puede encontrar en cualquier tipo de comida en cantidades relativamente pequeñas. Se pueden encontrar grandes cantidades de flúor en el té y en los mariscos. El flúor es esencial para mantener la solidez de nuestros huesos. El flúor también nos puede proteger del decaimiento dental, si es aplicado con el dentífrico dos veces al día. Si se absorbe flúor con demasiada frecuencia, puede provocar caries, osteoporosis y daños a los riñones, huesos, nervios y músculos. Efectos ambientales del Flúor El flúor está presente en la corteza terrestre de forma natural, pudiendo ser encontrado en rocas, carbón y arcilla. Los fluoruros son liberados al aire cuando el viento arrastra el suelo. Los procesos de combustión en las industrias pueden liberar fluoruro de hidrógeno al aire. Los fluoruros que se encuentran en el aire acabarán depositándose en el suelo o en el agua. Cuando el flúor se fija a partículas muy pequeñas puede permanecer en el aire durante un largo periodo de tiempo. Cuando el flúor del aire acaba en el agua se instala en los sedimentos. Cuando acaba en los suelos, el flúor se pega fuertemente a las partículas del suelo.
- 11. Nombre Neón Número atómico 10 Valencia 0 Estado de oxidación - Electronegatividad - Radio covalente (Å) 1,31 Radio iónico (Å) - Radio atómico (Å) - Configuración electrónica 1s22s22p6 Primer potencial de ionización (eV) 21,68 Masa atómica (g/mol) 20,179 Densidad (g/ml) 1,20 Punto de ebullición (ºC) -246 Punto de fusión (ºC) -248,6 Descubridor Sir Ramsay en 1898 Se usan cantidades considerables de neón en la investigación física de alta energía. Las cámaras de centelleo con que se detecta el paso de partículas nucleares se llenan de neón. El neón líquido puede utilizarse como un refrigerante en el intervalo de 25-40 K (-416 a - 387ºF). También se utiliza en algunos tipos de tubos electrónicos, contadores Geiger-Müller, en lámparas probadoras de corriente eléctrica de alto voltaje. Con baja potencia eléctrica se produce luz visible en lámparas incandescentes de neón; tales lámparas son económicas y se usan como luces nocturnas y de seguridad. Efectos del Neón sobre la salud Vías de exposición: La sustancia puede ser absorbida por el cuerpo a través de la inhalación. Riesgo de inhalación: Si existen pérdidas en su contenedor este líquido se evapora con mucha rapidez provocando sobresaturación del aire con serio peligro de asfixia cuando se trata de recintos cerrados. Efectos de la exposición: Inhalación: Asfixiante simple. Piel: Congelación en contacto con el líquido. Ojos: Congelación en contacto con el líquido. Inhalación: Este gas es inerte y está clasificado como un asfixiante simple. La inhalación en concentraciones excesivas puede resultar en mareos, náuseas, vómitos, pérdida de consciencia y muerte. La muerte puede resultar de errores de juicio, confusión, o pérdida de la consciencia, que impiden el auto rescate. A bajas concentraciones de oxígeno, la pérdida de consciencia y la muerte pueden ocurrir en segundos sin ninguna advertencia. Efectos ambientales del Neón El neón es un gas raro atmosférico, y como tal no es tóxico y es químicamente inerte. No se conoce ningún daño ecológico causado por este elemento.
- 12. Nombre Sodio Número atómico 11 Valencia 1 Estado de oxidación +1 Electronegatividad 0,9 Radio covalente (Å) 1,54 Radio iónico (Å) 0,95 Radio atómico (Å) 1,90 Configuración electrónica [Ne]3s1 Primer potencial de ionización (eV) 5,14 Masa atómica (g/mol) 22,9898 Densidad (g/ml) 0,97 Punto de ebullición (ºC) 892 Punto de fusión (ºC) 97,8 Descubridor Sir Humphrey Davy en 1807 El sodio reacciona con rapidez con el agua, y también con nieve y hielo, para producir hidróxido de sodio e hidrógeno. Cuando se expone al aire, el sodio metálico recién cortado pierde su apariencia plateada y adquiere color gris opaco por la formación de un recubrimiento de óxido de sodio. El sodio no reacciona con nitrógeno, incluso a temperaturas muy elevadas, pero puede reaccionar con amoniaco para formar amida de sodio. El sodio y el hidrógeno reaccionan arriba de los 200ºC (390ºF) para formar el hidruro de sodio. El sodio reacciona difícilmente con el carbono, si es que reacciona, pero sí lo hace con los halógenos. También reacciona con varios halogenuros metálicos para dar el metal y cloruro de sodio. Efectos del Sodio sobre la salud El sodio es un componente de muchas comidas, por ejemplo la sal común. Es necesario para los humanos para mantener el balance de los sistemas de fluidos físicos. El sodio es también requerido para el funcionamiento de nervios y músculos. Un exceso de sodio puede dañar nuestros riñones e incrementa las posibilidades de hipertensión. Efectos ambientales del Sodio Ecotoxicidad: Límite Medio de Tolerancia (LMT) para el pez mosquito, 125 ppm/96hr (agua dulce); Límite Medio de Tolerancia (LMT) para el pez sol (Lepomis macrochirus), 88 88 mg/48hr (agua del grifo). Destino medioambiental: Este compuesto químico no es móvil en su forma sólida, aunque absorbe la humedad muy fácilmente. Una vez líquido, el hidróxido de sodio se filtra rápidamente en el suelo, con la posibilidad de contaminar las reserves de agua.
- 13. Nombre Magnesio Número atómico 12 Valencia 2 Estado de oxidación +2 Electronegatividad 1,2 Radio covalente (Å) 1,30 Radio iónico (Å) 0,65 Radio atómico (Å) 1,60 Configuración electrónica [Ne]3s2 Primer potencial de ionización (eV) 7,65 Masa atómica (g/mol) 24,305 Densidad (g/ml) 1,74 Punto de ebullición (ºC) 1107 Punto de fusión (ºC) 650 Descubridor Sir Humphrey Davy en 1808 Los iones magnesio disueltos en el agua forman depósitos en tuberías y calderas cuando el agua es dura, es decir, cuando contiene demasiado magnesio o calcio. Esto se puede evitar con los ablandadores de agua. Con una densidad de sólo dos tercios de la del aluminio, tiene incontables aplicaciones en casos en donde el ahorro de peso es de importancia. También tiene muchas propiedades químicas y metalúrgicas deseables que lo hacen apropiado en una gran variedad de aplicaciones no estructurales. Es muy abundante en la naturaleza, y se halla en cantidades importantes en muchos minerales rocosos, como la dolomita, magnesita, olivino y serpentina. Además se encuentra en el agua de mar, salmueras subterráneas y lechos salinos. Es el tercer metal estructural más abundante en la corteza terrestre, superado solamente por el aluminio y el hierro. Efectos del Magnesio sobre la salud Efectos de la exposición al magnesio en polvo: baja toxicidad y no considerado como peligroso para la salud. Inhalación: el polvo de magnesio puede irritar las membranas mucosas o el tracto respiratorio superior. Ojos: daños mecánicos o las partículas pueden incrustarse en el ojo. Visión directa del polvo de magnesio ardiendo sin gafas especiales puede resultar en ceguera temporal, debido a la intensa llama blanca. Piel: Incrustación de partículas en la piel. Ingestión: Poco posible; sin embargo, la ingestión de grandes cantidades de polvo de magnesio puede causar daños. Efectos ambientales del Magnesio Hay muy poca información disponible acerca de los efectos ambientales de los vapores de óxido de magnesio. Si otros mamíferos inhalan vapores de óxido de magnesio, pueden sufrir efectos similares a los de los humanos. En un espectro del 0 al 3, los vapores de óxido de magnesio registran un 0,8 de peligrosidad para el medioambiente. Una puntuación de 3 representa un peligro muy alto para el medioambiente y una puntuación de 0 representa un peligro insignificante. Los factores tomados en cuenta para la obtención de este ranking incluyen el grado de perniciosita del material y/o su carencia de toxicidad, y la medida de su capacidad de permanecer activo en el medioambiente y si se acumula o no en los organismos vivos. No tiene en cuenta el grado de exposición a la sustancia.
- 14. Nombre Aluminio Número atómico 13 Valencia 3 Estado de oxidación +3 Electronegatividad 1,5 Radio covalente (Å) 1,18 Radio iónico (Å) 0,50 Radio atómico (Å) 1,43 Configuración electrónica [Ne]3s23p1 Primer potencial de ionización (eV) 6,00 Masa atómica (g/mol) 26,9815 Densidad (g/ml) 2,70 Punto de ebullición (ºC) 2450 Punto de fusión (ºC) 660 Descubridor Hans Christian Oersted en 1825 El aluminio es el elemento metálico más abundante en la Tierra y en la Luna, pero nunca se encuentra en forma libre en la naturaleza. Se halla ampliamente distribuido en las plantas y en casi todas las rocas, sobre todo en las ígneas, que contienen aluminio en forma de minerales de alúmina silicato. Cuando estos minerales se disuelven, según las condiciones químicas, es posible precipitar el aluminio en forma de arcillas minerales, hidróxidos de aluminio o ambos. En esas condiciones se forman las bauxitas que sirven de materia prima fundamental en la producción de aluminio. Efectos del Aluminio sobre la salud El Aluminio es uno de los metales más ampliamente usados y también uno de los más frecuentemente encontrados en los compuestos de la corteza terrestre. Debido a este hecho, el aluminio es comúnmente conocido como un compuesto inocente. Pero todavía, cuando uno es expuesto a altas concentraciones, este puede causar problemas de salud. La forma soluble en agua del Aluminio causa efectos perjudiciales, estas partículas son llamadas iones. Son usualmente encontradas en soluciones de Aluminio combinadas con otros iones, por ejemplo cloruro de Aluminio. La toma de Alumino puede tener lugar a través de la comida, respirarlo y por contacto en la piel. La toma de concentraciones significantes de Aluminio puede causar un efecto serio en la salud como: •Daño al sistema nervioso central •Demencia •Pérdida de la memoria •Apatía •Temblores severos Efectos ambientales del Aluminio Los efectos del Aluminio han atraído nuestra atención, mayormente debido a los problemas de acidificación. El Aluminio puede acumularse en las plantas y causar problemas de salud a animales que consumen esas plantas. Las concentraciones de Aluminio parecen ser muy altas en lagos acidificados. En estos lagos un número de peces y anfibios están disminuyendo debido a las reacciones de los iones de Aluminio con las proteínas de las agallas de los peces y los embriones de las ranas. Elevadas concentraciones de Aluminio no sólo causan efectos sobre los peces, pero también sobre los pájaros y otros animales que consumen peces contaminados e insectos y sobre animales que respiran el Aluminio a través del aire.
- 15. Nombre Silicio Número atómico 14 Valencia 4 Estado de oxidación +4 Electronegatividad 1,8 Radio covalente (Å) 1,11 Radio iónico (Å) 0,41 Radio atómico (Å) 1,32 Configuración electrónica [Ne]3s23p2 Primer potencial de ionización (eV) 8,15 Masa atómica (g/mol) 28,086 Densidad (g/ml) 2,33 Punto de ebullición (ºC) 2680 Punto de fusión (ºC) 1410 Descubridor Jons Berzelius en 1823 El silicio elemental crudo y sus compuestos Inter metálicos se emplean como integrantes de aleaciones para dar mayor resistencia al aluminio, magnesio, cobre y otros metales. el silicio metalúrgico con pureza del 98-99% se utiliza como materia prima en la manufactura de compuestos organosilícicos y resinas de silicona, elastómeros y aceites. Los chips de silicio se emplean en circuitos integrados. Las células fotovoltaicas para la conversión directa de energía solar en eléctrica utilizan obleas cortadas de cristales simples de silicio de grado electrónico. El dióxido de silicio se emplea como materia prima para producir silicio elemental y carburo de silicio. Los cristales grandes de silicio se utilizan para cristales piezoeléctricos. Las arenas de cuarzo fundido se transforman en vidrios de silicio que se usan en los laboratorios y plantas químicas, así como en aislantes eléctricos. Se emplea una dispersión coloidal de silicio en agua como agente de recubrimiento y como ingrediente de ciertos esmaltes. Efectos del Silicio sobre la salud El silicio elemental es un material inerte, que parece carecer de la propiedad de causar fibrosis en el tejido pulmonar. Sin embargo, se han documentado lesiones pulmonares leves en animales de laboratorio sometidos a inyecciones intratraqueales de polvo de silicio. El polvo de silicio tiene pocos efectos adversos sobre los pulmones y no parece producir enfermedades orgánicas significativas o efectos tóxicos cuando las exposiciones se mantienen por debajo de los límites de exposición recomendados. El silicio puede tener efectos crónicos en la respiración. El silicio cristalino (dióxido de silicio) es un potente peligro para la respiración. Sin embargo, la probabilidad de que se produzca dióxido de silicio durante los procesamientos normales es muy remota. LD50 (oral)-3160 mg/kg. (LD50: Dosis Letal 50. Dosis individual de una sustancia que provoca la muerte del 50% de la población animal debido a la exposición a la sustancia por cualquier vía distinta a la inhalación. Normalmente expresada como miligramos o gramos de material por kilogramo de peso del animal.) Efectos ambientales del Silicio No se ha informado de efectos negativos del silicio sobre el medio ambiente.
- 16. Nombre Fósforo Número atómico 15 Valencia +3,-3,5,4 Estado de oxidación +5 Electronegatividad 2,1 Radio covalente (Å) 1,06 Radio iónico (Å) 0,34 Radio atómico (Å) 1,28 Configuración electrónica [Ne]3s23p3 Primer potencial de ionización (eV) 11,00 Masa atómica (g/mol) 30,9738 Densidad (g/ml) 1,82 Punto de ebullición (ºC) 280 Punto de fusión (ºC) 44,2 Descubridor Hennig Brandt en 1669 El fósforo forma la base de gran número de compuestos, de los cuales los más importantes son los fosfatos. En todas las formas de vida, los fosfatos desempeñan un papel esencial en los procesos de transferencia de energía, como el metabolismo, la fotosíntesis, la función nerviosa y la acción muscular. Los ácidos nucleicos, que entre otras cosas forman el material hereditario (los cromosomas), son fosfatos, así como cierto número de coenzimas. Los esqueletos de los animales están formados por fosfato de calcio. Cerca de tres cuartas partes del fósforo total (en todas sus formas químicas) se emplean en Estados Unidos como fertilizantes. Otras aplicaciones importantes son como relleno de detergentes, nutrientes suplementarios en alimentos para animales, ablandadores de agua, aditivos para alimentos y fármacos, agentes de revestimiento en el tratamiento de superficies metálicas, aditivos en metalurgia, plastificantes, insecticidas y aditivos de productos petroleros. Efectos del Fósforo sobre la salud El Fósforo puede ser encontrado en el ambiente más comúnmente como fosfato. Los fosfatos son substancias importantes en el cuerpo de los humanos porque ellas son parte del material de ADN y tienen parte en la distribución de la energía. Los fosfatos pueden ser encontrados comúnmente en plantas. Los humanos han cambiado el suministro natural de fósforo radicalmente por la adición de estiércol ricos en fosfatos. El fosfato era también añadido a un número de alimentos, como quesos, salsas, jamón. Demasiado fosfato puede causar problemas de salud, como es daño a los riñones y osteoporosis. La disminución de fosfato también puede ocurrir. Estas son causadas por uso extensivo de medicinas. Demasiado poco fosfato puede causar problemas de salud. Efectos ambientales del Fósforo Fósforo blanco: El fósforo blanco estar en el ambiente cuando es usado en industrias para hacer otros productos químicos y cuando el ejército lo usa como munición. A través de descargas de aguas residuales el fósforo blanco termina en las aguas superficiales cerca de las fábricas donde es usado. El fósforo blanco no es probablemente esparcido, porque este reacciona con el oxígeno bastante rápido. Cuando el fósforo termina en el aire a través de los tubos de escape este terminará usualmente reaccionando con el oxígeno al instante para convertirse en partículas menos peligrosas. Pero en suelos profundos y en el fondo de los ríos y lagos el fósforo puede permanecer miles de años y más. Fosfatos: Los fosfatos tienen muchos efectos sobre los organismos. Los efectos son mayormente consecuencias de las emisiones de grandes cantidades de fosfatos en el ambiente debido a la minería y los cultivos. Durante la purificación del agua los fosfatos no son a menudo eliminado correctamente, así que pueden expandirse a través de largas distancias cuando se encuentran en la superficie de las aguas.
- 17. Nombre Azufre Número atómico 16 Valencia +2,2,4,6 Estado de oxidación -2 Electronegatividad 2,5 Radio covalente (Å) 1,02 Radio iónico (Å) 1,84 Radio atómico (Å) 1,27 Configuración electrónica [Ne]3s23p4 Primer potencial de ionización (eV) 10,36 Masa atómica (g/mol) 32,064 Densidad (g/ml) 2,07 Punto de ebullición (ºC) 444,6 Punto de fusión (ºC) 119,0 Descubridor Los antiguos Propiedades: Los alótropos del azufre (diferentes formas cristalinas) han sido estudiados ampliamente, pero hasta ahora las diversas modificaciones en las cuales existen para cada estado (gas, líquido y sólido) del azufre elemental no se han dilucidado por completo. El azufre rómbico, llamado también azufre y azufre alfa, es la modificación estable del elemento por debajo de los 95.5ºC (204ºF, el punto de transición), y la mayor parte de las otras formas se revierten a esta modificación si se las deja permanecer por debajo de esta temperatura. El azufre rómbico es de color amarillo limón, insoluble en agua, ligeramente soluble en alcohol etílico, éter dietílico y benceno, y es muy soluble en disulfuro de carbono. Su densidad es 2.07 g/cm3 (1.19 oz/in3) y su dureza es de 2.5 en la escala de Mohs. Su fórmula molecular es S8. Efectos del Azufre sobre la salud El azufre se puede encontrar frecuentemente en la naturaleza en forma de sulfuros. Durante diversos procesos se añaden al medio ambiente enlaces de azufre dañinos para los animales y los hombres. Estos enlaces de azufre dañinos también se forman en la naturaleza durante diversas reacciones, sobre todo cuando se han añadido sustancias que no están presentes de forma natural. Los compuestos del azufre presentan un olor desagradable y a menudo son altamente tóxicos. En general las sustancias sulfurosas pueden tener los siguientes efectos en la salud humana: •Efectos neurológicos y cambios comportamentales •Alteración de la circulación sanguínea •Daños cardiacos •Efectos en los ojos y en la vista •Fallos reproductores •Daños al sistema inmunitario •Desórdenes estomacales y gastrointestinales •Daños en las funciones del hígado y los riñones •Defectos en la audición •Alteraciones del metabolismo hormonal •Efectos dermatológicos •Asfixia y embolia pulmonar Efectos ambientales del Azufre El azufre puede encontrarse en el aire en varias formas diferentes. Puede provocar irritaciones en los ojos y garganta de los animales, cuando la toma tiene lugar a través de la inhalación del azufre en su fase gaseosa. El azufre se aplica extensivamente en las industrias y es emitido al aire, debido a las limitadas posibilidades de destrucción de los enlaces de azufre que se aplican. Los efectos dañinos del azufre en los animales son principalmente daños cerebrales, a través de un malfuncionamiento del hipotálamo, y perjudicar el sistema nervioso. Pruebas de laboratorio con animales de prueba han indicado que el azufre puede causar graves daños vasculares en las venas del cerebro, corazón y riñones. Estos tests también han indicado que ciertas formas del azufre pueden causar daños fetales y efectos congénitos. Las madres pueden incluso transmitirles envenenamiento por azufre a sus hijos a través de la leche materna.
- 18. Nombre Cloro Número atómico 17 Valencia +1,-1,3,5,7 Estado de oxidación -1 Electronegatividad 3.0 Radio covalente (Å) 0,99 Radio iónico (Å) 1,81 Radio atómico (Å) - Configuración electrónica [Ne]3s23p5 Primer potencial de ionización (eV) 13,01 Masa atómica (g/mol) 35,453 Densidad (g/ml) 1,56 Punto de ebullición (ºC) -34,7 Punto de fusión (ºC) -101,0 Descubridor Carl Wilhelm Scheele en 1774 Fabricación: El primer proceso electrolítico para la producción de cloro fue patentado en 1851 por Charles Watt en Gran Bretaña. En 1868, Henry Deacon produjo cloro a partir de ácido clorhídrico y oxígeno a 400ºC (750ºF), con cloruro de cobre impregnado en piedra pómez como catalizador. Las celdas electrolíticas modernas pueden clasificarse casi siempre como pertenecientes al tipo de diafragma y de mercurio. Ambas producen sustancias cáusticas (NaOH o KOH), cloro e hidrógeno. La política económica de la industria del cloro y de los álcalis incluye principalmente la mercadotecnia equilibrada o el uso interno del cáustico y del cloro en las proporciones en las que se obtienen mediante el proceso de la celda electrolítica. El cloro es uno de los cuatro elementos químicos estrechamente relacionados que han sido llamados halógenos. El flúor es el más activo químicamente; el yodo y el bromo son menos activos. El cloro reemplaza al yodo y al bromo de sus sales. Interviene en reacciones de sustitución o de adición tanto con materiales orgánicos como inorgánicos. El cloro seco es algo inerte, pero húmedo se combina directamente con la mayor parte de los elementos. Efectos del Cloro sobre la salud El cloro es un gas altamente reactivo. Es un elemento que se da de forma natural. Los mayores consumidores de cloro son las compañías que producen dicloruro de etileno y otros disolventes clorinados, resinas de cloruro de polivinilo (PVC), clorofluorocarbonos (CFCs) y óxido de propileno. Las compañías papeleras utilizan cloro para blanquear el papel. Las plantas de tratamiento de agua y de aguas residuales utilizan cloro para reducir los niveles de microorganismos que pueden propagar enfermedades entre los humanos (desinfección). Los efectos del cloro en la salud humana dependen de la cantidad de cloro presente, y del tiempo y la frecuencia de exposición. Los efectos también dependen de la salud de la persona y de las condiciones del medio cuando la exposición tuvo lugar. La respiración de pequeñas cantidades de cloro durante cortos periodos de tiempo afecta negativamente al sistema respiratorio humano. Los efectos van desde tos y dolor pectoral hasta retención de agua en los pulmones. El cloro irrita la piel , los ojos y el sistema respiratorio. No es probable que estos efectos tengan lugar a niveles de cloro encontrados normalmente en la naturaleza. Efectos ambientales del Cloro El cloro se disuelve cuando se mezcla con el agua. También puede escaparse del agua e incorporarse al aire bajo ciertas condiciones. La mayoría de las emisiones de cloro al medio ambiente son al aire y a las aguas superficiales. Una vez en el aire o en el agua, el cloro reacciona con otros compuestos químicos. Se combina con material inorgánico en el ahua para formar sales de cloro, y con materia orgánica para formar compuestos orgánicos clorinados. Debido a su reactividad no es probable que el cloro se mueva a través del suelo y se incorpore a las aguas subterráneas.
- 19. Nombre Argón Número atómico 18 Valencia 0 Estado de oxidación - Electronegatividad - Radio covalente (Å) 1,74 Radio iónico (Å) - Radio atómico (Å) - Configuración electrónica [Ne]3s23p6 Primer potencial de ionización (eV) 15,80 Masa atómica (g/mol) 39,948 Densidad (g/ml) 1,40 Punto de ebullición (ºC) -185,8 Punto de fusión (ºC) -189,4 Descubridor Sir Ramsay en 1894 El uso en gran escala más antiguo del argón es en lámparas eléctricas o bombillas. El corte y soldadura de metales consume la mayor parte del argón. Los procesos metalúrgicos constituyen la aplicación de más rápido crecimiento. El argón y las mezclas de argón-kriptón se utilizan, con un poco de vapor de mercurio, para llenar lámparas fluorescentes. El argón mezclado con algo de neón se utiliza para llenar tubos fluorescentes de descarga eléctrica empleados en letreros de propaganda (parecidos a los anuncios de neón); esto se hace cuando se desea un color azul o verde en lugar del color rojo del neón. El argón se utiliza también para llenar tiratrones de contadores de radiación Geiger-Müller, en cámaras de ionización con las que se mide la radiación cósmica y tubos electrónicos de varias clases. La atmósfera de argón se utiliza en la manipulación de reactivos químicos en el laboratorio y en el sellado de empaques de estos materiales. Efectos del Argón sobre la salud Vías de exposición: La sustancia puede ser absorbida por el cuerpo por inhalación. Riesgo de inhalación: En caso de escape en el contenedor este líquido se evapora muy rápidamente provocando supersaturación del aire con grave peligro de asfixia cuando esto ocurre en un recinto cerrado. Efectos de la exposición: Inhalación: Mareos. Pesadez. Dolor de cabeza. Asfixia. Piel: Congelación en contacto con el líquido. Ojos: Congelación en contacto con el líquido. Inhalación: Este gas es inerte y está clasificado como un asfixiante simple. La inhalación de éste en concentraciones excesivas puede resultar en mareos, náuseas, vómitos, pérdida de consciencia y muerte. La muerte puede resultar de errores de juicio, confusión, o pérdida de la consciencia, que impiden el auto rescate. A bajas concentraciones de oxígeno, la pérdida de consciencia y la muerte pueden ocurrir en segundos sin ninguna advertencia. Efectos ambientales del Argón No se conocen efectos ambientales negativos causados por el argón ni se esperan consecuencias ambientales adversas. El argón se da naturalmente en el medio ambiente. El gas se disipará rápidamente en áreas bien ventiladas. Actualmente no se conocen los efectos del argón en plantas y animales. No se espera que perjudique a los organismos acuáticos.
- 20. Nombre Potasio Número atómico 19 Valencia 1 Estado de oxidación +1 Electronegatividad 0,8 Radio covalente (Å) 1,96 Radio iónico (Å) 1,33 Radio atómico (Å) 2,35 Configuración electrónica [Ar]4s1 Primer potencial de ionización (eV) 4,37 Masa atómica (g/mol) 39,098 Densidad (g/ml) 0,97 Punto de ebullición (ºC) 760 Punto de fusión (ºC) 97,8 Descubridor Sir Davy en 1808 El cloruro de potasio se utiliza principalmente en mezclas fertilizantes. Sirve también como material de partida para la manufactura de otros compuestos de potasio (potasio). El hidróxido de potasio se emplea en la manufactura de jabones líquidos y el carbonato de potasio para jabones blandos. El carbonato de potasio es también un material de partida importante en la industria del vidrio. El nitrato de potasio se utiliza en fósforos, fuegos pirotécnicos y en artículos afines que requieren un agente oxidante. El potasio es un elemento muy abundante y es el séptimo entre todos los elementos de la corteza terrestre; el 2.59% de ella corresponde a potasio en forma combinada. El agua de mar contiene 380 ppm, lo cual significa que el potasio es el sexto más abundante en solución. Efectos del Potasio sobre la salud El potasio puede ser encontrado en vegetales, frutas, patatas, carne, pan, leche y frutos secos. Juega un importante papel en los sistemas de fluidos físicos de los humanos y asiste en las funciones de los nervios. Cuando nuestros riñones no funcionan bien se puede dar la acumulación de potasio. Esto puede llevar a cabo una perturbación en el ritmo cardiaco. Efectos ambientales del Potasio Junto con el nitrógeno y el fósforo, el potasio es uno de los macronutrients esenciales para la supervivencia de las plantas. Su presencia es de gran importancia para la salud del suelo, el crecimiento de las plantas y la nutrición animal. Su función primaria en las plantas es su papel en el mantenimiento de la presión osmótica y el tamaño de la célula, influyendo de esta forma en la fotosíntesis y en la producción de energía, así como en la apertura de los estomas y el aporte de dióxido de carbono, la turgencia de la planta y la translocación de los nutrientes. Como tal, el elemento es requerido en proporciones relativamente elevadas por las plantas en desarrollo. Las consecuencias de niveles bajos de potasio se muestran por variedad de síntomas: restricción del crecimiento, reducción del florecimiento, cosechas menos abundantes y menor calidad de producción. Elevados niveles de potasio soluble en el agua pueden causar daños a las semillas en germinación, inhiben la toma de otros minerales y reducen la calidad del cultivo.
- 21. Nombre Calcio Número atómico 20 Valencia 2 Estado de oxidación +2 Electronegatividad 1,0 Radio covalente (Å) 1,74 Radio iónico (Å) 0,99 Radio atómico (Å) 1,97 Configuración electrónica [Ar]4s2 Primer potencial de ionización (eV) 6,15 Masa atómica (g/mol) 40,08 Densidad (g/ml) 1,55 Punto de ebullición (ºC) 1440 Punto de fusión (ºC) 838 Descubridor Sir Humphrey Davy en 1808 El calcio metálico se prepara en la industria por electrólisis del cloruro de calcio fundido. Éste se obtiene por tratamiento de los minerales de carbonato con ácido clorhídrico o como un desperdicio del proceso Solvay de los carbonatos. El metal puro puede ser maquinado en torno, hilado, serrado, extruido; se le puede convertir en alambre, prensar y amartillar en placas. El calcio forma una película fina de óxido y nitruro en el aire, la cual lo protege de un ataque posterior. Se quema en el aire a temperatura elevada para producir principalmente nitruro. El metal producido en forma comercial reacciona fácilmente con el agua y los ácidos y produce hidrógeno que contiene cantidades notables de amoniaco e hidrocarburos como impurezas. El metal se emplea en aleaciones de aluminio para cojinetes, como auxiliar en la remoción del bismuto del plomo, así como controlador de carbono grafítico en el hierro fundido. Se emplea también como desoxidante en la manufactura de muchos aceros; como agente reductor en la preparación de metales como el cromo, torio, zirconio y uranio, y como material de separación para mezclas gaseosas de nitrógeno y argón. Efectos del Calcio sobre la salud Cuando hablamos del calcio algunas veces nos referimos a él con el nombre de cal. Es comúnmente encontrado en la leche y productos lácteos, pero también en frutos secos, vegetales, etc. Es un componente esencial para la preservación del esqueleto y dientes de los humanos. También asiste en funciones de los nervios y musculares. El uso de más de 2,5 gramos de calcio por día sin una necesidad médica puede llevar a cabo el desarrollo de piedras en los riñones, esclerosis y problemas en los vasos sanguíneos. La falta de calcio es una de las causas principales de la osteoporosis. La osteoporosis es una enfermedad caracterizada por una fragilidad de los huesos producida por una menor cantidad de sus componentes minerales, lo que disminuye su densidad. Al contrario de lo que mucha gente piensa, dentro de nuestros huesos se desarrolla una gran actividad biológica. Continuamente los huesos se están renovando y el tejido óseo viejo se está continuamente reemplazando por tejido nuevo. Durante la niñez y la adolescencia se crea más tejido óseo que el que se destruye. Sin embargo, en algún momento, posiblemente cercano a los 30 o 35 años de edad el proceso se invierte y comenzamos a perder más tejido óseo del que podemos reemplazar. En las mujeres al llegar la menopausia (cesación natural de la menstruación) se acelera el proceso ya que los ovarios dejan de producir la hormona femenina conocida como estrógeno, una de cuyas funciones es preservar la masa ósea. Efectos ambientales del Calcio El fosfato de calcio es muy tóxico para los organismos acuáticos.
- 22. Nombre Escandio Número atómico 21 Valencia 3 Estado de oxidación +3 Electronegatividad 1,3 Radio covalente (Å) 1,44 Radio iónico (Å) 0,81 Radio atómico (Å) 1,62 Configuración electrónica [Ar]3d14s2 Primer potencial de ionización (eV) 6,59 Masa atómica (g/mol) 44,956 Densidad (g/ml) 3,0 Punto de ebullición (ºC) 2730 Punto de fusión (ºC) 1539 Descubridor Lars Nilson en 1879 El óxido y otros compuestos del escandio se emplean como catalizadores en la conversión de ácido acético en acetona, en la manufactura de propanol y en la conversión de ácidos dicarboxílicos en cetonas y compuestos cíclicos. El tratamiento con solución de sulfato de escandio es un medio económico para mejorar la germinación de semillas de muchas especies vegetales. El escandio-47 tiene una vida media adecuada para su empleo como trazador y se puede preparar sin transportador. La presencia de un 2.5-25% de átomos de escandio en el ánodo incrementa el voltaje, la estabilidad de éste y la vida de las baterías alcalinas de níquel. Efectos del Escandio sobre la salud El escandio es uno de los productos químicos raros, que puede encontrarse en las casas en equipos como televisiones en color, lámparas fluorescentes, lámparas ahorradoras de energía y cristales. Todos los productos químicos raros tienen propiedades comparables. El escandio se raramente se puede encontrar en la naturaleza, ya que se da en cantidades muy pequeñas. El escandio se encuentra normalmente solo en dos tipos diferentes de menas minerales. El uso del escandio todavía está creciendo, debido al hecho de que es adecuado para producir catalizadores y para pulir cristales. El escandio es principalmente peligroso en el lugar de trabajo, debido al hecho de que las humedades y los gases pueden ser inhalados con el aire. Esto puede provocar embolias pulmonares, especialmente durante largas exposiciones. El escandio puede ser una amenaza para el hígado cuando se acumula en al cuerpo humano. Efectos ambientales del Escandio El escandio es vertido al medio ambiente en muchos lugares diferentes, principalmente por industrias productoras de petróleo. También pueden entrar en el medio ambiente cuando se tiran los equipos domésticos. El escandio se acumula gradualmente en los suelos y el agua y esto conducirá finalmente al incremento de las concentraciones en humanos, animales y partículas del suelo. En los animales acuáticos el escandio produce daños a las membranas celulares, lo que tiene diversas influencias negativas en la reproducción y en las funciones del sistema nervioso.
- 23. Nombre Titanio Número atómico 22 Valencia 2,3,4 Estado de oxidación +4 Electronegatividad 1,5 Radio covalente (Å) 1,36 Radio iónico (Å) 0,68 Radio atómico (Å) 1,47 Configuración electrónica [Ar]3d24s2 Primer potencial de ionización (eV) 6,89 Masa atómica (g/mol) 47,90 Densidad (g/ml) 4,51 Punto de ebullición (ºC) 3260 Punto de fusión (ºC) 1668 Descubridor William Gregor en 1791 El dióxido de titanio se utiliza mucho como un pigmento blanco en pinturas exteriores por ser químicamente inerte, por su gran poder de recubrimiento, su opacidad al daño por la luz UV y su capacidad de autolimpieza. El dióxido también se ha empleado como agente blanqueador y opacado en esmaltes de porcelana, dando un acabado final de gran brillo, dureza y resistencia al ácido. Los titanatos alcalinotérreos poseen algunas propiedades notables. El nivel de constantes dieléctricas fluctúa entre 13 para el MgTiO3, y varios miles para soluciones sólidas de SrTiO3 en BaTiO3. El titanato de bario también tiene una constante dieléctrica de 10.000 cerca de los 120ºC (250ºF), que es su punto Curie; posee histéresis dieléctrica baja. Los transductores cerámicos que contienen titanato de bario se comparan favorablemente con la sal de Rochelle y el cuarzo, respecto a la estabilidad térmica en el primer caso, y la fuerza del efecto y la capacidad para formar la cerámica en varias formas en el segundo caso. El compuesto se ha utilizado como generador de vibraciones ultrasónicas y como detector de sonidos. Efectos del Titanio sobre la salud El titanio elemental y el dióxido de titanio tienen un nivel bajo de toxicidad. Animales de laboratorio (ratas) expuestos a dióxido de titanio por inhalación han desarrollado pequeñas áreas localizadas de polvo oscuro depositado en los pulmones. Una exposición excesiva en los humanos puede resultar en ligeros cambios en los pulmones. Efectos de la sobreexposición al polvo de titanio: La inhalación del polvo puede causar tirantez y dolor en el pecho, tos, y dificultad para respirar. El contacto con la piel y los ojos puede provocar irritación. Vías de entrada: Inhalación, contacto con la piel, contacto con los ojos. Carcinogenicidad: La agencia internacional para la investigación del cáncer (IARC) ha incluido el dióxido de titanio en el grupo 3 (el agente no es clasificable con respecto a su carcinogenicidad en humanos). Efectos ambientales del Titanio Baja toxicidad. No se han documentado efectos ambientales negativos del titanio.
- 24. Nombre Vanadio Número atómico 23 Valencia 2,3,4,5 Estado de oxidación +3 Electronegatividad 1,6 Radio covalente (Å) 1,25 Radio iónico (Å) 0,74 Radio atómico (Å) 1,34 Configuración electrónica [Ar]3d34s2 Primer potencial de ionización (eV) 6,81 Masa atómica (g/mol) 50,942 Densidad (g/ml) 4,51 Punto de ebullición (ºC) 3450 Punto de fusión (ºC) 1900 Descubridor Nils Sefstrom en 1830 El vanadio se parece a algunos otros elementos de transición en que forma muchos compuestos que con frecuencia son complejos por su valencia variable. Tiene al menos tres estados de oxidación, 2+, 3+ y 5+. Es anfótero, principalmente básico en los estados de oxidación bajos y ácido en los altos. Forma derivados de radicales más o menos bien definidos, tales como VO2+ y VO3+. En su forma pura es blando y dúctil. Puede trabajarse en caliente y frío fácilmente, pero debe calentarse en una atmósfera inerte o al vacío a causa de que se oxida rápido a temperaturas por encima del punto de fusión de su óxido. El metal retiene muy bien su fuerza a temperaturas elevadas. La resistencia del vanadio a los ácidos clorhídrico y sulfúrico es notable y resiste el ataque del agua salada aereada mejor que la mayor parte de los aceros inoxidables. Sin embargo, el vanadio no resiste al ácido nítrico. Efectos del Vanadio sobre la salud La mayor acumulación de Vanadio en los seres humanos tiene lugar a través de las comidas, como es, trigo, semilla de soja, aceite de oliva, aceite de girasol, manzanas y huevos. El Vanadio puede tener un número de efectos sobre la salud humana, cuando la toma es muy alta. Cuando el Vanadio es acumulado a través del aire, puede causar bronquitis y neumonía. Los efectos graves del Vanadio son irritación de pulmones, garganta, ojos y cavidades nasales. Otros efectos sobre la salud cuando se toma Vanadio son: •Daño cardiáco y vascular. •Inflamación del estómago e intestinos •Daño en el sistema nervioso •Sangrado del hígado y riñones •Irritación de la piel •Temblores severos y parálisis •Sangrado de la nariz y dolor de cabeza •Mareos •Cambios de comportamiento Efectos ambientales del Vanadio El Vanadio puede ser encontrado en el ambiente, en algas, plantas, invertebrados, peces y muchas otras especies. En mejillones y cangrejos se acumula fuertemente, el cual puede ser acumulado en concentraciones de 105 a 106 veces mayores que las concentraciones que son encontradas en el agua salada. El Vanadio causa la inhibición de ciertas enzimas de animales, lo cual tiene varios efectos neurológicos. Próximo a los efectos neurológicos el Vanadio puede causar desordenes respiratorios, parálisis y efectos negativos en el hígado y los riñones. Las pruebas de laboratorio en pruebas con animales han mostrado, que el Vanadio puede causar daño en el sistema reproductivo de animales machos, y el Vanadio puede causar alteraciones del ADN en algunos casos, pero no puede causar cáncer en animales.
- 25. Nombre Cromo Número atómico 24 Valencia 2,3,4,5,6 Estado de oxidación +3 Electronegatividad 1,6 Radio covalente (Å) 1,27 Radio iónico (Å) 0,69 Radio atómico (Å) 1,27 Configuración electrónica [Ar]3d54 s1 Primer potencial de ionización (eV) 6,80 Masa atómica (g/mol) 51,996 Densidad (g/ml) 7,19 Punto de ebullición (ºC) 2665 Punto de fusión (ºC) 1875 Descubridor Vaughlin en 1797 Sus propiedades mecánicas, incluyendo su dureza y la resistencia a la tensión, determinan la capacidad de utilización. El cromo tiene una capacidad relativa baja de forjado, enrollamiento y propiedades de manejo. Sin embargo, cuando se encuentra absolutamente libre de oxígeno, hidrógeno, carbono y nitrógeno es muy dúctil y puede ser forjado y manejado. Es difícil de almacenarlo libre de estos elementos. El cromo forma tres series de compuestos con otros elementos; éstos se representan en términos de los óxidos de cromo: cromo con valencia dos, CrO, óxido de Cr(II) u óxido cromoso; con valencia tres, Cr2O3, óxido de Cr(III) u óxido crómico, y con valencia seis, CrO3, anhídrido de Cr(VI) o anhídrido de ácido crómico. El cromo es capaz de formar compuestos con otros elementos en estados de oxidación (II), (III) y (VI). Efectos del Cromo sobre la salud La gente puede estar expuesta al Cromo a través de respirarlo, comerlo o beberlo y a través del contacto con la piel con Cromo o compuestos del Cromo. El nivel de Cromo en el aire y el agua es generalmente bajo. En agua para beber el nivel de Cromo es usualmente bajo como en el agua de pozo, pero el agua de pozo contaminada puede contener el peligroso Cromo (VI); Cromo hexavalente. Para la mayoría de la gente que come comida que contiene Cromo III es la mayor ruta de entrada de Cromo, como Cromo III ocurre naturalmente en muchos vegetales, frutas, carnes, levaduras y granos. Varias maneras de preparación de la comida y almacenaje pueden alterar el contenido de Cromo en la comida. Cuando la comida es almacenada en tanques de acero o latas las concentraciones de Cromo pueden aumentar. El Cromo III es un nutriente esencial para los humanos y la falta de este puede causar condiciones del corazón, transtornos metabólicos y diabetes. Pero la toma de mucho Cromo III puede causar efectos sobre la salud también, por ejemplo erupciones cutáneas. •Erupciones cutáneas •Malestar de estómago y úlceras •Problemas respiratorios •Debilitamiento del sistema inmune •Daño en los riñones e hígado •Alteración del material genético •Cáncer de pulmón •Muerte Efectos ambientales del Cromo Hay varias clases diferentes de Cromo que difieren de sus efectos sobre los organismos. El Cromo entra en el aire, agua y suelo en forma de Cromo (III) y Cromo (VI) a través de procesos naturales y actividades humanas. Las mayores actividades humanas que incrementan las concentraciones de Cromo (III) son el acero, las peleterias y las industrias textiles, pintura electrica y otras aplicaciones industriales del Cromo (VI). Estas aplicaciones incrementarán las concentraciones del Cromo en agua. A través de la combustión del carbón el Cromo será también emitido al agua y eventualmente se disolverá.
- 26. Nombre Manganeso Número atómico 25 Valencia 2,3,4,6,7 Estado de oxidación +2 Electronegatividad 1,5 Radio covalente (Å) 1,39 Radio iónico (Å) 0,80 Radio atómico (Å) 1,26 Configuración electrónica [Ar]3d54s2 Potencial primero de ionización (eV) 7,46 Masa atómica (g/mol) 54,938 Densidad (g/ml) 7,43 Punto de ebullición (ºC) 2150 Punto de fusión (ºC) 1245 Descubridor Johann Gahn en 1774 Elemento químico, símbolo Mn, de número atómico 25 y peso atómico 54.938. Es uno de los metales de transición del primer periodo largo de la tabla periódica; se encuentra entre el cromo y el hierro. Tiene propiedades en común con ambos metales. Aunque poco conocido o usado en su forma pura, reviste gran importancia práctica en la fabricación de acero. El manganeso se oxida con facilidad en el aire para formar una capa castaña de óxido. También lo hace a temperaturas elevadas. A este respecto su comportamiento es más parecido a su vecino de mayor número atómico en la tabla periódica ( el hierro), que al de menor número atómico, el cromo. El manganeso es un metal bastante reactivo. Aunque el metal sólido reacciona lentamente, el polvo metálico reacciona con facilidad y en algunos casos, muy vigorosamente. Cuando se calienta en presencia de aire u oxígeno, el manganeso en polvo forma un óxido rojo, Mn3O4. Con agua a temperatura ambiente se forman hidrógeno e hidróxido de manganeso(II), Mn(OH)2. En el caso de ácidos, y a causa de que el manganeso es un metal reactivo, se libera hidrógeno y se forma una sal de manganeso(II). El manganeso reacciona a temperaturas elevadas con los halógenos, azufre, nitrógeno, carbono, silicio, fósforo y boro. Efectos del Manganeso sobre la salud El Manganeso es un compuesto muy común que puede ser encontrado en todas partes en la tierra. El manganeso es uno de los tres elementos trazas tóxicos esenciales, lo cual significa que no es sólo necesario para la supervivencia de los humanos, pero que es también tóxico cuando está presente en elevadas concentraciones en los humanos. Cuando la gente no cumplen con la ración diaria recomendada su salud disminuirá. Pero cuando la toma es demasiado alta problemas de salud aparecerán. La toma de Manganeso por los humanos mayoritariamente tiene lugar a través de la comida, como son las espinacas, el te y la hierbas. Las comidas que contienen las más altas concentraciones son los granos y arroz, las semillas de soja, huevos, frutos secos, aceite de oliva, judías verdes y ostras. Después de ser absorbido en el cuerpo humano el manganeso será transportado a través de la sangre al hígado, los riñones, el páncreas y las glándulas endocrinas. Efectos ambientales del Manganeso Los compuestos del manganeso existen de forma natural en el ambiente como sólidos en suelos y pequeñas partículas en el agua. Las partículas de manganeso en el aire están presente en las partículas de polvo. Estas usualmente se depositan en la tierra en unos pocos días. Los humanos aumentan las concentraciones de Manganeso en el aire por las actividades industriales y a través de la quema de productos fósiles. El Manganeso que deriva de las fuentes humanas puede también entrar en la superficie del agua, aguas subterráneas y aguas residuales. A través de la aplicación del Manganeso como pesticida el Manganeso entrará en el suelo.
- 27. Nombre Hierro Número atómico 26 Valencia 2,3 Estado de oxidación +3 Electronegatividad 1,8 Radio covalente (Å) 1,25 Radio iónico (Å) 0,64 Radio atómico (Å) 1,26 Configuración electrónica [Ar]3d64s2 Primer potencial de ionización (eV) 7,94 Masa atómica (g/mol) 55,847 Densidad (g/ml) 7,86 Punto de ebullición (ºC) 3000 Punto de fusión (ºC) 1536 Descubridor Los antiguos El uso más extenso del hierro (fierro) es para la obtención de aceros estructurales; también se producen grandes cantidades de hierro fundido y de hierro forjado. Entre otros usos del hierro y de sus compuestos se tienen la fabricación de imanes, tintes (tintas, papel para heliográficas, pigmentos pulidores) y abrasivos (colcótar). Exiten varias forma alotrópicas del hierro. La ferrita es estable hasta 760ºC (1400ºF). El cambio del hierro B comprende principalmente una pérdida de permeabilidad magnética porque la estructura de la red (cúbica centrada en el cuerpo) permanece inalterada. La forma alotrópica tiene sus átomos en arreglos cúbicos con empaquetamiento cerrado y es estable desde 910 hasta 1400ºC (1670 hasta 2600ºF). Este metal es un buen agente reductor y, dependiendo de las condiciones, puede oxidarse hasta el estado 2+m 3+ o 6+. En la mayor parte de los compuestos de hierro está presente el ion ferroso, hierro(II), o el ion férrico, hierro(III), como una unidad distinta. Por lo común, los compuestos ferrosos son de color amarillo claro hasta café verdoso oscuro; el ion hidratado Fe(H2O)6 2+, que se encuentra en muchos compuestos y en solución, es verde claro. Este ion presenta poca tendencia a formar complejos de coordinación, excepto con reactivos fuertes, como el ion cianuro, las poliaminas y las porfirinas. El ion férrico, por razón de su alta carga (3+) y su tamaño pequeño, tiene una fuerte tendencia a capturar aniones. El ion hidratado Fe(H2O)6 3+, que se encuentra en solución, se combina con OH-, F-, Cl-, CN-, SCN-, N3 -, C2O4 2- y otros aniones para forma complejos de coordinación. Efectos del Hierro sobre la salud El Hierro puede ser encontrado en carne, productos integrales, patatas y vegetales. El cuerpo humano absorbe Hierro de animales más rápido que el Hierro de las plantas. El Hierro es una parte esencial de la hemoglobina: el agente colorante rojo de la sangre que transporta el oxígeno a través de nuestros cuerpos. Puede provocar conjuntivitis, coriorretinitis, y retinitis si contacta con los tejidos y permanece en ellos. La inhalación crónica de concentraciones excesivas de vapores o polvos de óxido de hierro puede resultar en el desarrollo de una neumoconiosis benigna, llamada siderosis, que es observable como un cambio en los rayos X. Efectos ambientales del Hierro El hierro (III)-O-arsenito, pentahidratado puede ser peligroso para el medio ambiente; se debe prestar especial atención a las plantas, el aire y el agua. Se recomienda encarecidamente que no se permita que el producto entre en el medio ambiente porque persiste en éste.
- 28. Nombre Cobalto Número atómico 27 Valencia 2,3 Estado de oxidación +3 Electronegatividad 1,8 Radio covalente (Å) 1,26 Radio iónico (Å) 0,63 Radio atómico (Å) 1,25 Configuración electrónica [Ar]3d74s2 Primer potencial de ionización (eV) 7,90 Masa atómica (g/mol) 58,93 Densidad (g/ml) 8,9 Punto de ebullición (ºC) 2900 Punto de fusión (ºC) 1495 Descubridor George Brandt en 1737 Se encuentra distribuido con amplitud en la naturaleza y forma, aproximadamente, el 0.001% del total de las rocas ígneas de la corteza terrestre, en comparación con el 0.02% del níquel. Se halla en meteoritos, estrellas, en el mar, en aguas dulces, suelos, plantas, animales y en los nódulos de manganeso encontrados en el fondo del océano. Se observan trazas de cobalto en muchos minerales de hierro, níquel, cobre, plata, manganeso y zinc; pero los minerales de cobalto importantes en el comercio son los arseniuros, óxidos y sulfuros. El cobalto y sus aleaciones son resistentes al desgaste y a la corrosión, aun a temperaturas elevadas. Entre sus aplicaciones comerciales más importantes están; la preparación de aleaciones para uso a temperaturas elevadas, aleaciones magnéticas, aleaciones para máquinas y herramientas, sellos vidrio a metal y la aleación dental y quirúrgica llamada vitallium. Las plantas y los animales necesitan cantidades pequeñas de cobalto. Su isótopo radiactivo producido artificialmente, cobalto-60, se utiliza mucho en la industria, la investigación y la medicina. Efectos del Cobalto sobre la salud El Cobalto está ampliamente dispersado en el ambiente de los humanos por lo que estos pueden ser expuesto a él por respirar el aire, beber agua y comer comida que contengan Cobalto. El Contacto cutáneo con suelo o agua que contenga Cobalto puede también aumentar la exposición. El Cobalto no está a menudo libremente disponible en el ambiente, pero cuando las partículas del Cobalto no se unen a las partículas del suelo o sedimento la toma por las plantas y animales es mayor y la acumulación en plantas y animales puede ocurrir. El Cobalto es beneficioso para los humanos porque forma parte de la vitamina B12, la cual es esencial para la salud humana. El cobalto es usado para tratar la anemia en mujeres embarazadas, porque este estimula la producción de glóbulos rojos. De cualquier manera, muy alta concentracíon de Cobalto puede dañar la salud humana. Cuando respiramos elevadas concentraciones de Cobalto a través del aire experimentamos efectos en los pulmones, como asma y neumonia. Esto ocurre principalmente en gente que trabaja con Cobalto. Efectos ambientales del Cobalto El Cobalto no puede ser destruido una vez que este ha entrado en el medioambiente. Puede reaccionar con otras partículas o ser absorbido por las partículas del suelo o el agua. El Cobalto se mueve sólo bajo condiciones ácidas, pero al final la mayoría del Cobalto terminará en el suelo y sedimentos. Los suelo que contienen muy bajas cantidades de Cobalto puede que las plantas que crecen en ellos tengan una deficiencia de Cobalto. Cuando los animales pastorean sobre estos suelos ellos sufren una carencia de Cobalto, el cual es esencial para ellos.
- 29. Nombre Níquel Número atómico 28 Valencia 2,3 Estado de oxidación +2 Electronegatividad 1,8 Radio covalente (Å) 1,21 Radio iónico (Å) 0,78 Radio atómico (Å) 1,24 Configuración electrónica [Ar]3d84s2 Primer potencial de ionización (eV) 7,68 Masa atómica (g/mol) 58,71 Densidad (g/ml) 8,9 Punto de ebullición (ºC) 2730 Punto de fusión (ºC) 1453 Descubridor Alex Constedt 1751 La mayor parte del níquel comercial se emplea en el acero inoxidable y otras aleaciones resistentes a la corrosión. También es importante en monedas como sustituto de la plata. El níquel finamente dividido se emplea como catalizador de hidrogenación. El níquel es un elemento bastante abundante, constituye cerca de 0.008% de la corteza terrestre y 0.01% de las rocas ígneas. En algunos tipos de meteoritos hay cantidades apreciables de níquel, y se piensa que existen grandes cantidades en el núcleo terrestre. Dos minerales importantes son los sulfuros de hierro y níquel, pentlandita y pirrotita (Ni, Fe)xSy; el mineral garnierita, (Ni, Mg)SiO3.nH2O, también es importante en el comercio. El níquel se presenta en pequeñas cantidades en plantas y animales. Está presente en pequeñas cantidades en el agua de mar, el petróleo y en la mayor parte del carbón. Efectos del Níquel sobre la salud El níquel es un elemento que ocurre en el ambiente sólo en muy pequeños niveles. Los humanos usan el níquel para muchas aplicaciones diferentes. La aplicación más común del níquel es el uso como ingrediente del acero y otros productos metálicos. Este puede ser encontrado en productos metálicos comunes como es la joyería. •Elevadas probabilidades de desarrollar cáncer de pulmón, nariz, laringe y próstata. •Enfermedades y mareos después de la exposición al gas de níquel. •Embolia de pulmón. •Fallos respiratorios. •Defectos de nacimiento. •Asma y bronquitis crónica. •Reacciones alérgicas como son erupciones cutáneas, mayormente de las joyas. •Desordenes del corazón. Efectos ambientales del Níquel El níquel es liberado al aire por las plantas de energía y las incineradoras de basuras. Este se depositará en el suelo o caerá después de reaccionar con las gotas de lluvia. Usualmente lleva un largo periodo de tiempo para que el níquel sea eliminado del aire. El níquel puede también terminar en la superficie del agua cuando es parte de las aguas residuales. La mayor parte de todos los compuestos del níquel que son liberados al ambiente se absorberán por los sedimentos o partículas del suelo y llegará a inmovilizarse. En suelos ácidos, el níquel se une para llegar a ser más móvil y a menudo alcanza el agua subterránea. No hay mucha más información disponible sobre los efectos del níquel sobre los organismos y los humanos. Sabemos que altas concentraciones de níquel en suelos arenosos puede claramente dañar a las plantas y altas concentraciones de níquel en aguas superficiales puede disminuir el rango de crecimiento de las algas.
- 30. Nombre Cobre Número atómico 29 Valencia 1,2 Estado de oxidación +2 Electronegatividad 1,9 Radio covalente (Å) 1,38 Radio iónico (Å) 0,69 Radio atómico (Å) 1,28 Configuración electrónica [Ar]3d104 s1 Primer potencial de ionización (eV) 7,77 Masa atómica (g/mol) 63,54 Densidad (g/ml) 8,96 Punto de ebullición (ºC) 2595 Punto de fusión (ºC) 1083 Descubridor Los antiguos Elemento químico, de símbolo Cu, con número atómico 29; uno de los metales de transición e importante metal no ferroso. Su utilidad se debe a la combinación de sus propiedades químicas, físicas y mecánicas, así como a sus propiedades eléctricas y su abundancia. El cobre fue uno de los primeros metales usados por los humanos. La mayor parte del cobre del mundo se obtiene de los sulfuros minerales como la calcocita, covelita, calcopirita, bornita y enargita. Los minerales oxidados son la cuprita, tenorita, malaquita, azurita, crisocola y brocantita. El cobre natural, antes abundante en Estados Unidos, se extrae ahora sólo en Michigan. El grado del mineral empleado en la producción de cobre ha ido disminuyendo regularmente, conforme se han agotado los minerales más ricos y ha crecido la demanda de cobre. Hay grandes cantidades de cobre en la Tierra para uso futuro si se utilizan los minerales de los grados más bajos, y no hay probabilidad de que se agoten durante un largo periodo. Efectos ambientales del Cobre La producción mundial de Cobre está todavía creciendo. Esto básicamente significa que más y más Cobre termina en le medioambiente. Los ríos están depositando barro en sus orillas que están contaminados con Cobre, debido al vertido de aguas residuales contaminadas con Cobre. El Cobre entra en el aire, mayoritariamente a través de la liberación durante la combustión de fuel. El Cobre en el aire permanecerá por un periodo de tiempo eminente, antes de depositarse cuando empieza a llover. Este terminará mayormente en los suelos, como resultado los suelos pueden también contener grandes cantidades de Cobre después de que esté sea depositado desde el aire. El Cobre puede ser liberado en el medioambiente tanto por actividades humanas como por procesos naturales. Ejemplo de fuentes naturales son las tormentas de polvo, descomposición de la vegetación, incendios forestales y aerosoles marinos. Unos pocos de ejemplos de actividades humanas que contribuyen a la liberación del Cobre han sido ya nombrado. Otros ejemplos son la minería, la producción de metal, la producción de madera y la producción de fertilizantes fosfatados. Efectos del Cobre sobre la salud El Cobre es una substancia muy común que ocurre naturalmente y se extiende a través del ambiente a través de fenómenos naturales, los humanos usan ampliamente el Cobre. Por ejemplo este es aplicado en industrias y en agricultura. La producción de Cobre se ha incrementado en las últimas décadas y debido a esto las cantidades de Cobre en el ambiente se ha expandido. El Cobre puede ser encontrado en muchas clases de comidas, en el agua potable y en el aire. Debido a que absorbemos una cantidad eminente de cobre cada día por la comida, bebiendo y respirando. Las absorción del Cobre es necesaria, porque el Cobre es un elemento traza que es esencial para la salud de los humanos
- 31. Nombre Zinc Número atómico 30 Valencia 2 Estado de oxidación +2 Electronegatividad 1,6 Radio covalente (Å) 1,31 Radio iónico (Å) 0,74 Radio atómico (Å) 1,38 Configuración electrónica [Ar]3d104s2 Primer potencial de ionización (eV) 9,42 Masa atómica (g/mol) 65,37 Densidad (g/ml) 7,14 Punto de ebullición (ºC) 906 Punto de fusión (ºC) 419,5 Descubridor Andreas Marggraf en 1746 Los usos más importantes del zinc los constituyen las aleaciones y el recubrimiento protector de otros metales. El hierro o el acero recubiertos con zinc se denominan galvanizados, y esto puede hacerse por inmersión del artículo en zinc fundido (proceso de hot-dip), depositando zinc electrolíticamente sobre el artículo como un baño chapeado (electrogalvanizado), exponiendo el artículo a zinc en polvo cerca de su punto de fusión (sherardizing) o rociándolo con zinc fundido (metalizado). El zinc es uno de los elementos menos comunes; se estima que forma parte de la corteza terrestre en un 0.0005-0.02%. Ocupa el lugar 25 en orden de abundancia entre los elementos. Su principal mineral es la blenda, marmatita o esfalerita de zinc, ZnS. Es un elemento esencial para el desarrollo de muchas clases de organismos vegetales y animales. Efectos del Zinc sobre la salud El Zinc es una substancia muy común que ocurre naturalmente. Muchos alimentos contienen ciertas concentraciones de Zinc. El agua potable también contiene cierta cantidad de Zinc. La cual puede ser mayor cuando es almacenada en tanques de metal. Las fuentes industriales o los emplazamientos para residuos tóxicos pueden ser la causa del Zinc en el agua potable llegando a niveles que causan problemas. El Zinc es un elemento traza que es esencial para la salud humana. Cuando la gente absorben demasiado poco Zinc estos pueden experimentar una pérdida del apetito, disminución de la sensibilidad, el sabor y el olor. Pequeñas llagas, y erupciones cutáneas. La acumulación del Zinc puede incluso producir defectos de nacimiento. Efectos ambientales del Zinc El Zinc ocurre de forma natural en el aire, agua y suelo, pero las concentraciones están aumentando por causas no naturales, debido a la adición de Zinc a través de las actividades humanas. La mayoría del Zinc es adicionado durante actividades industriales, como es la minería, la combustión de carbón y residuos y el procesado del acero. La producción mundial de Zinc está todavía creciendo. Esto significa básicamente que más y más Zinc termina en el ambiente. El agua es contaminado con Zinc, debido a la presencia de grandes cantidades de Zinc en las aguas residuales de plantas industriales. Esta agua residuales no son depuradas satisfactoriamente. Una de las consecuencias es que los ríos están depositando fango contaminado con Zinc en sus orillas. El zinc puede también incrementar la acidez de las aguas.
- 32. Nombre Galio Número atómico 31 Valencia 3 Estado de oxidación +3 Electronegatividad 1,6 Radio covalente (Å) 1,26 Radio iónico (Å) 0,62 Radio atómico (Å) 1,41 Configuración electrónica [Ar]3d104 s24p1 Primer potencial de ionización (eV) 6,02 Masa atómica (g/mol) 69,72 Densidad (g/ml) 5,91 Punto de ebullición (ºC) 2237 Punto de fusión (ºC) 29,8 Elemento químico, símbolo Ga, número atómico 31 y peso atómico 69.72. lo descubrió Lecoq de Boisbaudran en Francia en 1875. Tiene un gran intervalo de temperatura en el estado líquido, y se ha recomendado su uso en termómetros de alta temperatura y manómetros. En aleación con plata y estañó, el galio suple en forma adecuada la amalgama en curaciones dentales; también sirve para soldar materiales no metálicos, incluyendo gemas o amtales. El arseniuro de galio puede utilizarse en sistemas para transformar movimiento mecánico en impulsos eléctricos. Los artículos sintéticos superconductores pueden prepararse por la fabricación de matrices porosas de vanadio o tántalo impregnados con hidruro de galio. El galio ha dado excelentes resultados como semiconductor para uso en rectificadores, transistores, fotoconductores, fuentes de luz, diodos láser o máser y aparatos de refrigeración. El galio sólido parece gris azulado cuando se expone a la atmósfera. El galio líquido es blanco plateado, con una superficie reflejante brillante. Su punto de congelación es más bajo que el de cualquier metal con excepción del mercurio (-39ºC o -38ºF) y el cesio (28.5ºC u 83.3ºF). Efectos del Galio sobre la salud El galio es un elemento que se encuentra en el cuerpo, pero en cantidades muy pequeñas. Por ejemplo, en una persona con una masa de 70 kilos, hay 0,7 miligramos de galio en su cuerpo. Si esta cantidad de galio estuviera condensada en un cubo, el cubo solo mediría 0,49 milímetros de lado. No tiene beneficios privados en las funciones corporales, y lo más probable es que solo esté presente debido a las pequeñas cantidades en el ambiente natural, en el agua, y en los residuos en los vegetales o frutas. Se sabe que algunas vitaminas y aguas de distribución comercial contienen cantidades traza de galio de menos de una parte por millón. El galio puro no es una sustancia peligrosa por contacto para los humanos. Ha sido manipulada muchas veces solo por el simple placer de observar como se derrite por el calor emitido por una mano humana. Efectos ambientales del Galio Una controversia con el galio involucra las armas nucleares y la polución. El galio es usado para unir las minas entre sí. Sin embargo, cuando las minas se cortan y se forma polvo de óxido de plutonio, el galio permanece en el plutonio. El plutonio se ve inutilizado para su uso como combustible porque el galio es corrosivo para varios otros elementos. Si el galio es eliminado, sin embargo, el plutonio se vuelve útil de nuevo. El problema es que el proceso para eliminar el galio contribuye a una gran cantidad de polución en el agua con sustancias radiactivas. El galio es un elemento ideal para ser usado en minas, pero la polución es destructiva para La Tierra y para la salud de sus habitantes.
- 33. Nombre Germanio Número atómico 32 Valencia 4 Estado de oxidación +4 Electronegatividad 1,8 Radio covalente (Å) 1,22 Radio iónico (Å) 0,53 Radio atómico (Å) 1,37 Configuración electrónica [Ar]3d104s24p2 Primer potencial de ionización (eV) 8,16 Masa atómica (g/mol) 72,59 Densidad (g/ml) 5,32 Punto de ebullición (ºC) 2830 Punto de fusión (ºC) 937,4 Descubridor Clemens Winkler 1886 El germanio es divalente o tetravalente. Los compuestos divalentes (óxido, sulfuro y los halogenuros) se oxidan o reducen con facilidad. Los compuestos tetravalentes son más estables. Los compuestos organogermánicos son numerosos y, en este aspecto, el germanio se parece al silicio. El interés en los compuestos organogermánicos se centra en su acción biológica. El germanio y sus derivados parecen tener una toxicidad menor en los mamíferos que los compuestos de estaño o plomo. Las propiedades del germanio son tales que este elemento tiene varias aplicaciones importantes, especialmente en la industria de los semiconductores. El primer dispositivo de estado sólido, el transistor, fue hecho de germanio. Los cristales especiales de germanio se usan como sustrato para el crecimiento en fase vapor de películas finas de GaAs y GaAsP en algunos diodos emisores de luz. Se emplean lentes y filtros de germanio en aparatos que operan en la región infrarroja del espectro. Mercurio y cobre impregnados de germanio son utilizados en detectores infrarrojos; los granates sintéticos con propiedades magnéticas pueden tener aplicaciones en los dispositivos de microondas para alto poder y memoria de burbuja magnética; los aditivos de germanio incrementa los amper- horas disponibles en acumuladores. Efectos del hidruro de Germanio y el tetra hidruro de germanio sobre la salud El hidruro de germanio y el tetra hidruro de germanio son extremadamente inflamables e incluso explosivos cuando son mezclados con el aire. Inhalación: Calambres abdominales. Sensación de quemadura. Tos. Piel: Enrojecimiento. Dolor. Ojos: Enrojecimiento. Dolor. Peligros físicos: El gas es más pesado que el aire y puede viajar por el suelo; es posible la ignición a distancia. Vías de exposición: La sustancia puede ser absorbida por el cuerpo por inhalación. Riesgo de inhalación: En caso de pérdidas en el contenedor se alcanzará rápidamente una concentración peligrosa del gas en el aire. Efectos ambientales del Germanio Como metal pesado se considera que tiene algún efecto negativo en los ecosistemas acuáticos.
- 34. Nombre Arsénico Número atómico 33 Valencia +3,-3,5 Estado de oxidación +5 Electronegatividad 2,1 Radio covalente (Å) 1,19 Radio iónico (Å) 0,47 Radio atómico (Å) 1,39 Configuración electrónica [Ar]3d104s24p3 Potencial primero de ionización (eV) 10,08 Masa atómica (g/mol) 74,922 Densidad (g/ml) 5,72 Punto de ebullición (ºC) 613 Punto de fusión (ºC) 817 Descubridor Los antiguos El arsénico elemental tiene pocos usos. Es uno de los pocos minerales disponibles con un 99.9999+ % de pureza. En el estado sólido se ha empleado ampliamente en los materiales láser GaAs y como agente acelerador en la manufactura de varios aparatos. El óxido de arsénico se utiliza en la elaboración de vidrio. Los sulfuros de arsénico se usan como pigmentos y en juegos pirotécnicos. El arseniato de hidrógeno se emplea en medicina, así como otros compuestos de arsénico. La mayor parte de la aplicación medicinal de los compuestos de arsénico se basa en su naturaleza tóxica. Efectos del Arsénico sobre la salud El Arsénico es uno de los más toxicos elementos que pueden ser encontrados. Debido a sus efectos tóxicos, los enlaces de Arsénico inorgánico ocurren en la tierra naturalmente en pequeñas cantidades. Los humanos pueden ser expuestos al Arsénico a través de la comida, agua y aire. La exposición puede también ocurrir a través del contacto con la piel con suelo o agua que contenga Arsérnico. Los niveles de Arsérnico en la comida son bastante bajos, no es añadido debido a su toxicidad, pero los niveles de Arsénico en peces y mariscos puede ser alta, porque los peces absorben Arsénico del agua donde viven. Por suerte esto esta es mayormente la forma de Arsénico orgánico menos dañina, pero peces que contienen suginificantes cantidades de Arsénico inorgánico pueden ser un peligro para la salud humana. La exposición al Arsénico puede ser más alta para la gente que trabaja con Arsénico, para gente que bebe significantes cantidades de vino, para gente que vive en casas que contienen conservantes de la madera y gente que viven en granjas donde el Arsénico de los pesticidas ha sido aplicados en el pasado. Efectos ambientales del Arsénico El Arsénico puede ser encontrado de forma natural en la tierra en pequeñas concentraciones. Esto ocurre en el suelo y minerales y puede entrar en el aire, agua y tierra a través de las tormentas de polvo y las aguas de escorrentía. El Arsénico es un componente que es extremadamente duro de convertir en productos solubre en agua o volátil. En realidad el Arsénico es naturalmente específicamente un compuesto móvil, básicamente significa que grandes concentraciones no aparecen probablemente en un sitio específico. Esto es una buena cosa, pero el punto negativo es que la contaminación por Arsénico llega a ser un tema amplio debido al fácil esparcimiento de este. El Arsénico no se puede movilizar fácilmente cuando este es inmóvil. Debido a las actividades humanas, mayormente a través de la minería y la fundiciones, naturalmente el Arsénico inmóvil se ha movilizado también y puede ahora ser encontrado en muchos lugares donde ellos no existían de forma natural.
- 35. Nombre Selenio Número atómico 34 Valencia +2,-2,4,6 Estado de oxidación -2 Electronegatividad 2,4 Radio covalente (Å) 1,16 Radio iónico (Å) 1,98 Radio atómico (Å) 1,40 Configuración electrónica [Ar]3d104s 24p4 Primer potencial de ionización (eV) 9,82 Masa atómica (g/mol) 78,96 Densidad (g/ml) 4,79 Punto de ebullición (ºC) 685 Punto de fusión (ºC) 217 Descubridor Jons Berzelius 1817 Los empleos más importantes del selenio son el proceso de fotocopiado xerográfico, la decoloración de vidrios teñidos por compuestos de hierro, y también se usa como pigmento en plásticos, pinturas, barnices, vidrio y cerámica y tintas. Su utilización en rectificadores ha disminuido por el mayor empleo del silicio y el germanio en esta aplicación. El selenio se emplea también en exposímetros fotográficos y como aditivo metalúrgico que mejora la capacidad de ciertos aceros para ser maquinados. Efectos del Selenio sobre la salud Los humanos pueden estar expuestos al selenio de varias formas diferentes. La exposición al selenio tiene lugar bien a través de la comida o el agua, o cuando nos ponemos en contacto con tierra o aire que contiene altas concentraciones de selenio. Esto no es muy sorprendente, porque el selenio se da naturalmente en el medio ambiente de forma muy amplia y está muy extendido. La exposición al selenio tiene lugar principalmente a través de la comida, porque el selenio está presente naturalmente en los cereales y la carne. Los humanos necesitan absorber ciertas cantidades de selenio diariamente, con el objeto de mantener una buena salud. La comida normalmente contiene suficiente selenio para prevenir las enfermedades causadas por su carencia. La toma de selenio a través de la comida puede ser más elevada de lo normal en muchos casos, porque en el pasado se aplicaron muchos fertilizantes ricos en selenio en los cultivos. Efectos ambientales del Selenio El selenio se presenta naturalmente en el medio ambiente. Es liberado tanto a través de procesos naturales como de actividades humanas. En su forma natural el selenio como elemento no puede ser creado ni destruido, pero tiene la capacidad de cambiar de forma. Bajos niveles de selenio pueden terminar en suelos o agua a través de la erosión de las rocas. Será entonces tomado por las plantas o acabará en el aire cuando es absorbido en finas partículas de polvo. Es más probable que el selenio entre en el aire a través de la combustión de carbón y aceite, en forma de dióxido de selenio. Esta sustancia será transformada en ácido de selenio en el agua o el sudor. Las sustancias en el aire que contienen selenio son normalmente descompuestas en selenio y agua bastante deprisa, de forma que no son peligrosas para la salud de los organismos. Los niveles de selenio en el suelo y agua aumentan, porque el selenio sedimenta del aire y el selenio de los residuos también tiende a acabar en los suelos de los vertederos.