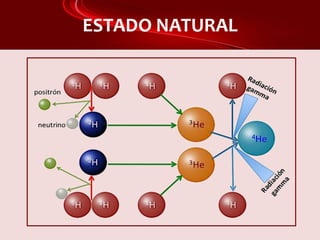
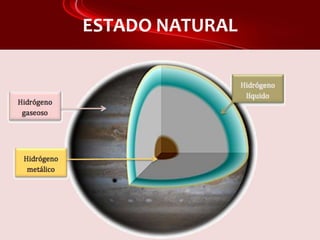
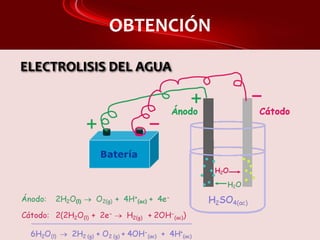
Este documento proporciona información sobre el hidrógeno, incluyendo sus características generales, isótopos, estado natural, propiedades magnéticas y reactividad, obtención y aplicaciones. El hidrógeno es el elemento más ligero, se obtiene principalmente a partir del metano y por electrólisis del agua, y se utiliza para producir amoníaco, metanol y en pilas de combustible como una alternativa a los combustibles fósiles.