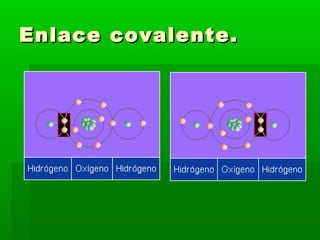
Un enlace químico se establece cuando los átomos comparten, ceden o adquieren electrones para alcanzar la configuración electrónica más estable de 8 electrones en su capa exterior. Existen tres tipos principales de enlace químico: iónico, que involucra la transferencia de electrones; covalente, que implica el compartir de electrones; y metálico, caracterizado por la deslocalización de electrones libres entre los núcleos atómicos.