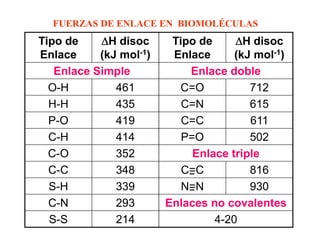
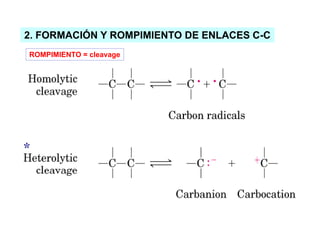
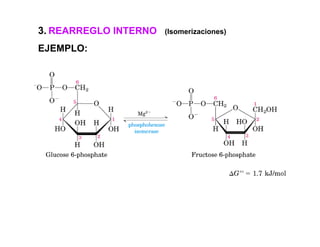
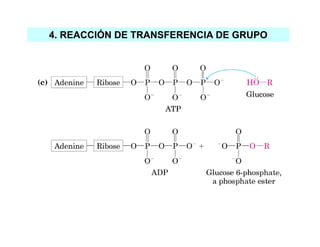
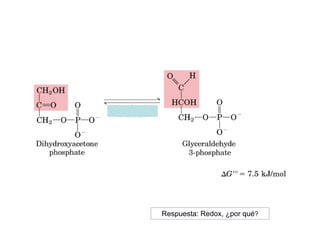
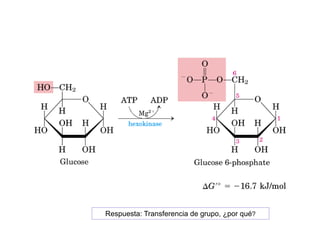
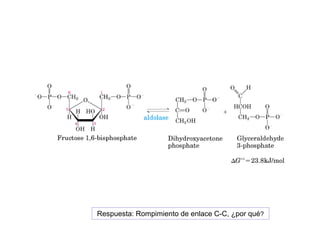
Las reacciones 6 y 8 implican la transferencia de un grupo funcional entre moléculas, por lo que son reacciones de transferencia de grupo. La reacción 7 implica un cambio en la configuración espacial de un doble enlace sin romper enlaces, por lo que es una isomerización. La reacción 10 implica el rompimiento de un enlace carbono-carbono, por lo que es un rompimiento de enlace C-C.