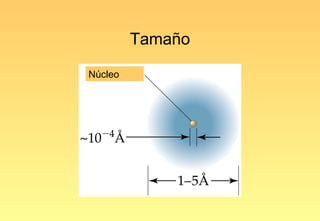
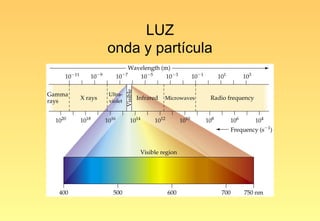
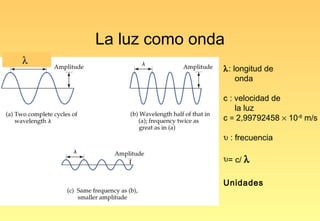
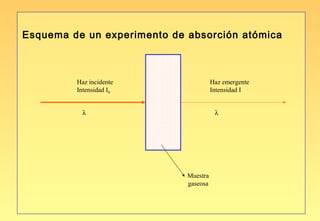
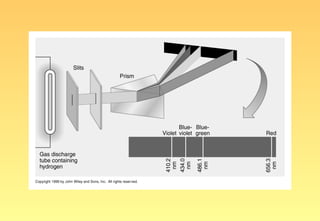
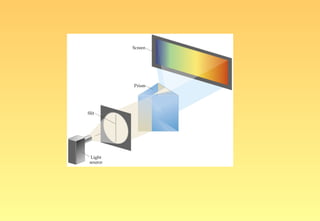
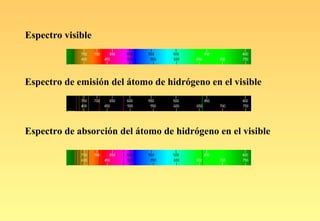
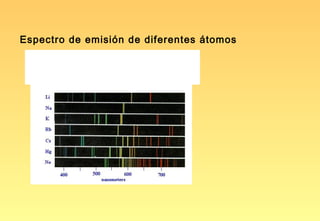
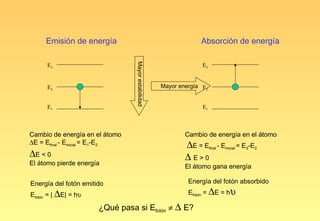
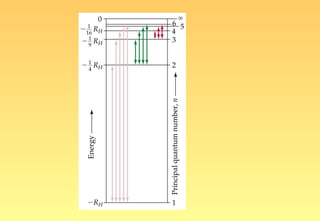
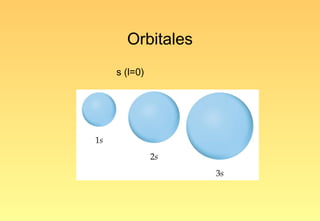
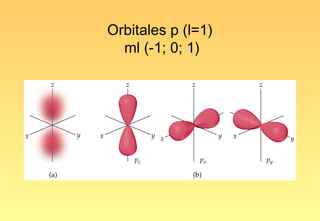
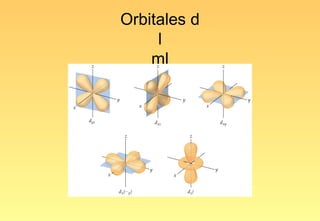
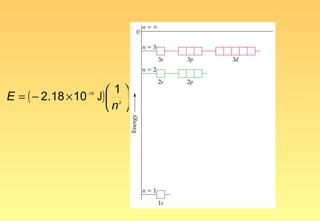
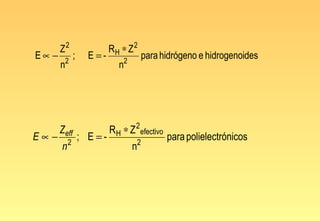
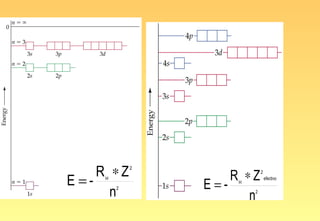
El documento resume la evolución del modelo atómico, desde los primeros modelos de Platón, Aristóteles y Demócrito, hasta el modelo actual basado en la mecánica cuántica. Explica las partículas subatómicas como el electrón y el protón, y cómo experimentos como el de Rutherford llevaron al modelo nuclear del átomo. También describe el comportamiento ondulatorio del electrón, el principio de incertidumbre de Heisenberg, y cómo la ecuación de Schrödinger explica los números cuánticos y los