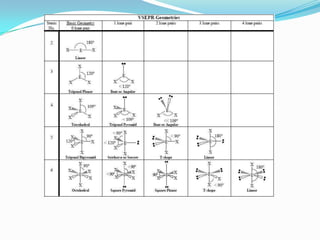
Los átomos se unen para alcanzar la mínima energía posible. Existen diferentes tipos de enlaces como el iónico, covalente y metálico. En el enlace iónico los iones se atraen electrostáticamente formando redes cristalinas, mientras que en el covalente los átomos comparten electrones de valencia. La geometría molecular depende de la teoría de repulsión de pares electrónicos.