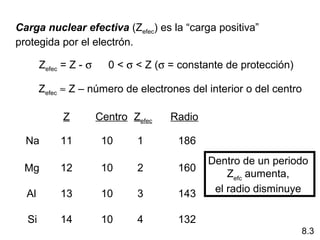
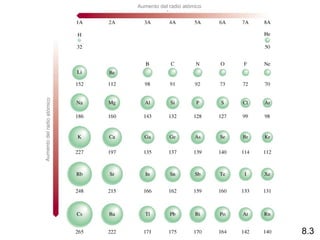
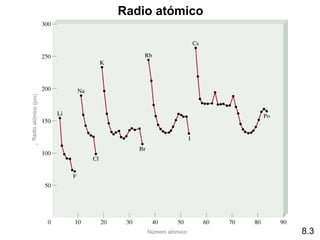
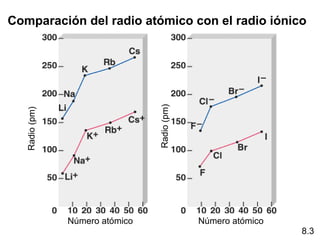
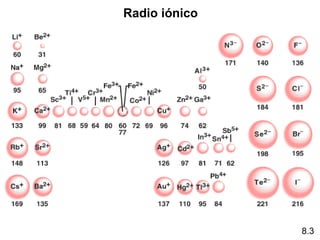
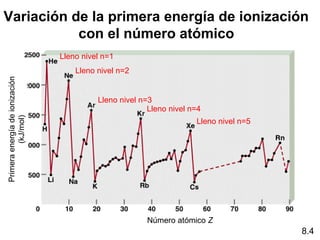
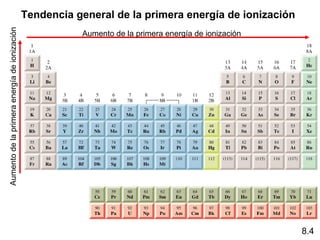
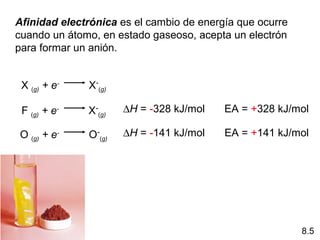
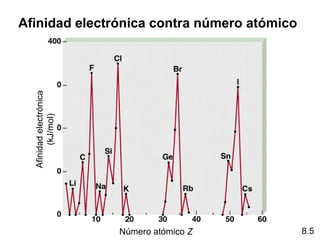
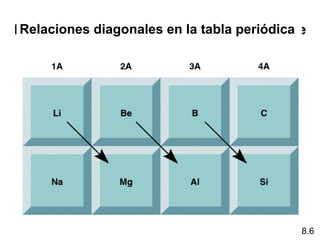
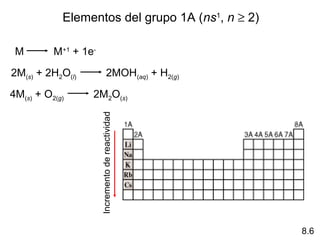
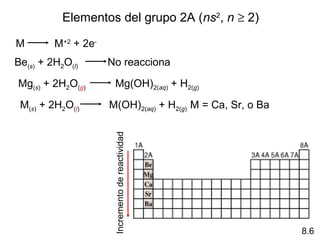
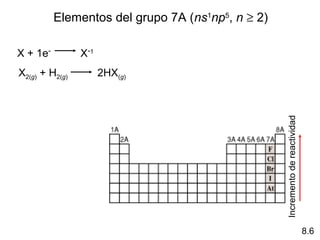
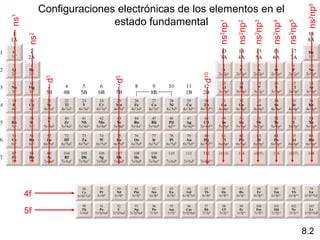
Este documento trata sobre las relaciones periódicas entre los elementos. Explica conceptos como la configuración electrónica de los elementos, cationes y aniones, radios atómicos e iónicos, energías de ionización y afinidad electrónica. También describe tendencias en los grupos principales como los incrementos en reactividad a lo largo de los períodos y grupos.

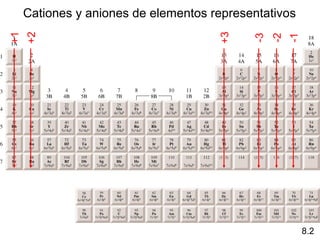
![Configuraciones electrónicas de cationes y aniones
de elementos representativos
Los átomos pierden
Na [Ne]3s 1 +
Na [Ne] electrones para que el catión
Ca [Ar]4s2 Ca2+ [Ar] tenga la configuración
electrónica externa de un gas
Al [Ne]3s23p1 Al3+ [Ne] noble.
H 1s1 H- 1s2 or [He]
Los átomos ganan
electrones para que el F 1s22s22p5 F- 1s22s22p6 o [Ne]
anión tenga una
configuración O 1s22s22p4 O2- 1s22s22p6 o [Ne]
electrónica externa de N 1s22s22p3 N3- 1s22s22p6 o [Ne]
un gas noble.
8.2](https://image.slidesharecdn.com/diapositivas081-130331154459-phpapp01/85/Relaciones-periodicas-entre-los-elementos-5-320.jpg)
![Na+: [Ne] Al3+: [Ne] F-: 1s22s22p6 o [Ne]
O2-: 1s22s22p6 o [Ne] N3-: 1s22s22p6 o [Ne]
Na+, Al3+, F-, O2-, y N3- son todos isoelectrónicos con Ne
¿Qué átomo neutral es isoelectrónico con H- ?
H-: 1s2 La misma configuración electrónica que He
8.2](https://image.slidesharecdn.com/diapositivas081-130331154459-phpapp01/85/Relaciones-periodicas-entre-los-elementos-7-320.jpg)
![Configuración electrónica de cationes de metales
de transición
Cuando un catión se forma de un átomo de un metal de
transición, los electrones que siempre se pierden primero son
los del orbital ns y después los de los orbitales (n–1)d.
Fe: [Ar]4s23d6 Mn: [Ar]4s23d5
Fe2+: [Ar]4s03d6 o [Ar]3d6 Mn2+: [Ar]4s03d5 o [Ar]3d5
Fe3+: [Ar]4s03d5 o [Ar]3d5
8.2](https://image.slidesharecdn.com/diapositivas081-130331154459-phpapp01/85/Relaciones-periodicas-entre-los-elementos-8-320.jpg)