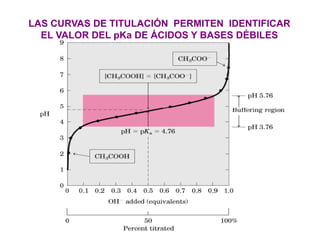
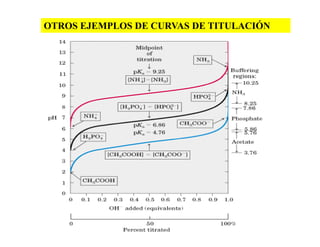
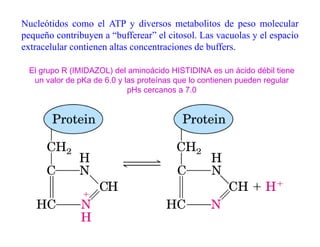
El documento describe los ácidos, bases y buffers, señalando que son esenciales para el funcionamiento celular y regulan el pH. Explica que los buffers mantienen el pH constante a través de reacciones reversibles entre un ácido débil y su base conjugada. También cubre conceptos como el pKa, curvas de titulación y ejemplos de buffers importantes como el de carbonatos en la sangre.


![Definición de ácidos y bases de Bronsted-Lowry
Ácido
Á id es…
“toda aquella sustancia que cede protones
(H+)”
Ácido: HA + H20 H30+ + A-
pH < 7.0, [H+] > 10-7 molar](https://image.slidesharecdn.com/acidosbasesybuffers-100407155208-phpapp02/85/Acidos-Bases-y-Buffers-3-320.jpg)
![Constante de disociación ácida (Ka )
(
HA + H2O H3O+ + A-
+ −
[ H 3O ][ A ]
Keq =
q
[ HA][ H 2O]
+ − + −
[ H 3O ][ A ] [ H ][ A ]
Ka = =
[ HA] [ HA]
pKa= - log Ka……](https://image.slidesharecdn.com/acidosbasesybuffers-100407155208-phpapp02/85/Acidos-Bases-y-Buffers-4-320.jpg)
![Una Base es…
“toda aquella sustancia que acepta protones “
q q p p
B: + H20 BH+ + OH-
Ejemplos: :NH3, CH3-NH2, CH3COO-,Cl-1
NH Cl
pH>7.0, [H ] < 10-7 molar
H>7 0 [H+] 7 l
Constante de Disociación básica (Kb)
+ −
[ BH ][OH ]
Kb = :
[B ]
pKb= - log Kb](https://image.slidesharecdn.com/acidosbasesybuffers-100407155208-phpapp02/85/Acidos-Bases-y-Buffers-5-320.jpg)
![• La Fuerza de un ácido o base puede calcularse a
partir de:
a) pH o pOH de la disolución
b) El grado de disociación del ácido ( )
) g (α),
entendido como… “ Número moléculas
disociadas en una disolución de determinada
molaridad” α= ([H+]/[HA])* 100
molaridad”.
– c) La Ka o Kb](https://image.slidesharecdn.com/acidosbasesybuffers-100407155208-phpapp02/85/Acidos-Bases-y-Buffers-6-320.jpg)
![Relación entre Ka y Kb
• Ka x Kb= [B:][H+] x [BH+][OH-] =[H+][OH-]
[BH+][OH ] =[H+][OH ]
[BH+] [B:]
• Ka x Kb= [A-][H+] x [HA][OH-] =[H+][OH-]
[HA] [A-]
Ka*Kb= Kw…. al tomar –log
pKa + pKb= 14
K Kb](https://image.slidesharecdn.com/acidosbasesybuffers-100407155208-phpapp02/85/Acidos-Bases-y-Buffers-7-320.jpg)
![Ejercicios
• Calcular el pH de Acético 0 1 molar y
0.1
(α)= 1.35%
• pH = ½ pKa – ½ de l C
H K d log
• α= ([H+]/[HA])*100
• Respuesta: pH= 2.88](https://image.slidesharecdn.com/acidosbasesybuffers-100407155208-phpapp02/85/Acidos-Bases-y-Buffers-8-320.jpg)




![ECUACIÓN DE
HENDERSON-HASSELBACH
Ka= [H+][A-]/[HA]
↓
↓
UTILIDAD: Calcular las moles de ácido y base conjugada,
necesarios para preparar un buffer de “X” pH y “Y” molaridad.](https://image.slidesharecdn.com/acidosbasesybuffers-100407155208-phpapp02/85/Acidos-Bases-y-Buffers-13-320.jpg)