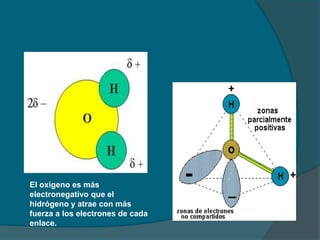
El documento describe el origen del agua en la Tierra hace mil millones de años, cuando los gases calientes como el oxígeno y el hidrógeno se condensaron y formaron las primeras nubes y depresiones que se llenaron de agua. También explica las propiedades físicas y químicas del agua, incluida su estructura molecular polar que le permite formar puentes de hidrógeno y disolver una amplia variedad de sustancias. El agua desempeña un papel fundamental en los ciclos biogeoquímicos y en