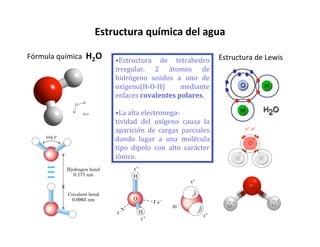
La molécula de agua tiene una estructura en forma de tetraedro irregular, con dos átomos de hidrógeno unidos covalentemente a un átomo de oxígeno. La alta electronegatividad del oxígeno genera cargas parciales que confieren a la molécula un carácter iónico y dipolar. Las moléculas de agua pueden formar enlaces de hidrógeno entre sí, dando lugar a una red tridimensional que explica las inusuales propiedades físicas del agua como sus altos puntos de fusión