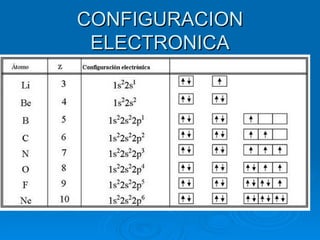
El documento resume la evolución del modelo atómico desde la antigua Grecia hasta el modelo cuántico de Bohr. Explica que los átomos están compuestos de un núcleo central rodeado por electrones que giran en órbitas definidas por números cuánticos. Cuando los electrones cambian de órbita, absorben o emiten fotones de energía específica que determina las líneas espectrales. El modelo cuántico introdujo conceptos como la dualidad onda-partícula y el principio de indeterminación de Heisenberg