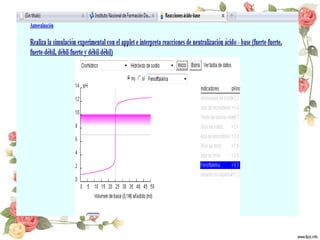
El documento resume conceptos clave sobre la neutralización de ácidos y bases. Explica que en la neutralización de un ácido fuerte con una base fuerte, el punto de equivalencia ocurre a pH 7 y es adecuado usar los indicadores azul de bromotimol o tornasol. En la neutralización de un ácido débil con una base fuerte, el punto de equivalencia es a pH > 7 y es mejor usar fenolftaleína o azul de timol. También compara la neutralización de un ácido fuerte con una base débil.