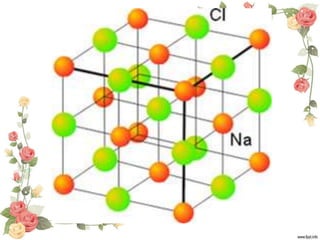
Este documento describe los diferentes tipos de enlaces químicos, incluyendo enlace iónico, enlace covalente, puente de hidrógeno y enlace dipolo-dipolo. Explica que el enlace iónico involucra la transferencia de electrones entre átomos, mientras que el enlace covalente implica el intercambio o compartición de electrones. También describe las propiedades de los compuestos iónicos y covalentes, como puntos de fusión, conductividad eléctrica y solubilidad.