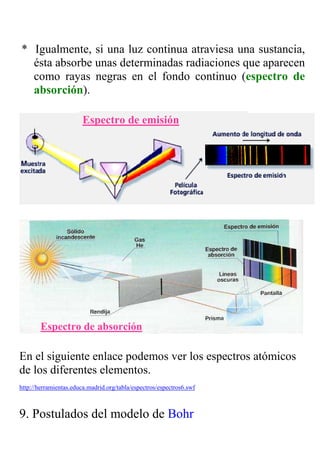
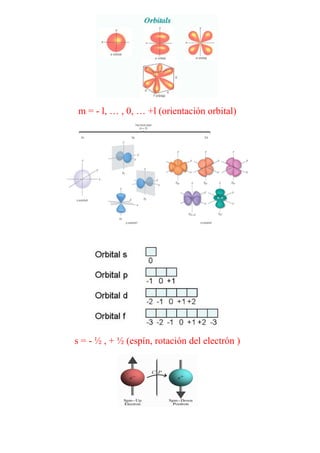
El documento describe la evolución de los modelos atómicos a lo largo de la historia, desde los primeros modelos de Demócrito y Dalton que propusieron que la materia estaba compuesta de átomos indivisibles, hasta el modelo mecánico-cuántico actual. El modelo de Rutherford introdujo el concepto de núcleo atómico con electrones orbitando alrededor, mientras que Bohr propuso que los electrones solo podían estar en órbitas cuantizadas. Finalmente, la mecánica cuántica reemplazó la