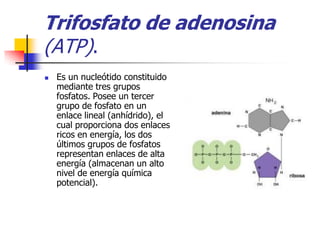
El documento trata sobre bioenergética y termodinámica. Explica que la energía es necesaria para que ocurran las reacciones bioquímicas en el organismo y que el ATP almacena y libera energía química para mantener los procesos corporales. También describe los principios de la termodinámica, incluyendo que la energía se conserva aunque se transforma, la entropía aumenta en los procesos irreversibles y la entropía es nula a 0K.