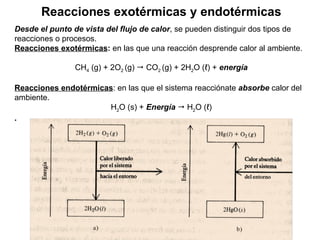
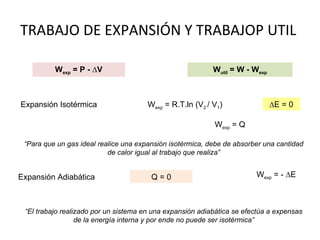
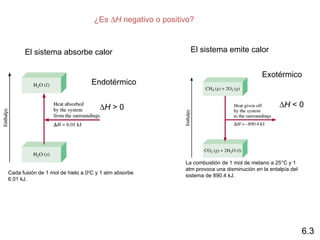
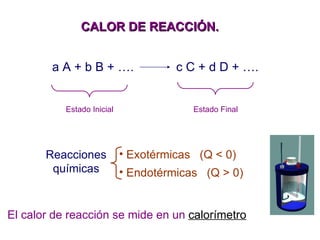
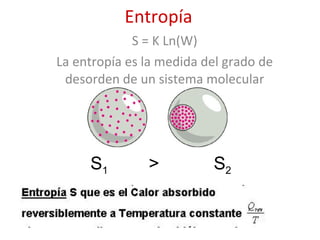
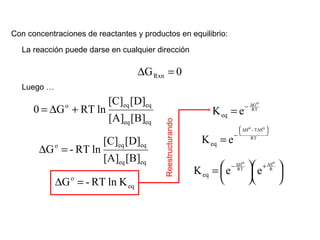
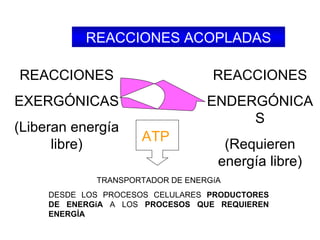
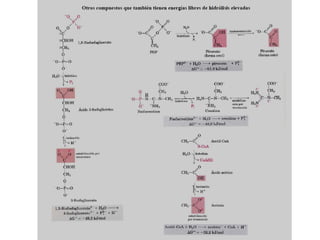
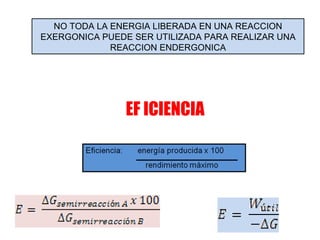
El documento trata sobre la termodinámica, la cual estudia la energía y sus transformaciones en sistemas desde un punto de vista macroscópico. Explica conceptos como sistema, entorno, variables de estado, transformaciones, tipos de procesos, reversibilidad, calor de reacción, leyes de la termodinámica y su aplicación en química y biología.