Este documento presenta un resumen de tres capítulos de un libro de texto sobre bioquímica. El primer capítulo introduce el concepto de bioquímica y las biomoléculas principales. El segundo capítulo cubre los ácidos nucleicos, incluidos los tipos y el código genético. El tercer capítulo trata sobre las proteínas, incluidos los aminoácidos, las clasificaciones de proteínas y las enzimas.


















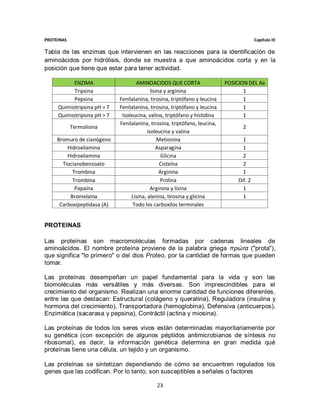











![PROTEINAS Capítulo III
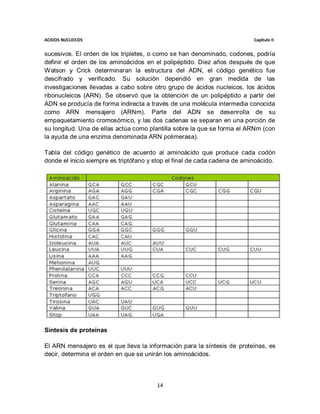
Cinética de michaelis-menten
Describe la velocidad de reacción de muchas reacciones enzimáticas. Su nombre
es en honor a Leonor Michaelis y Maude Menten. Este modelo sólo es válido
cuando la concentración del sustrato es mayor que la concentración de la enzima,
y para condiciones de estado estacionario, o sea que la concentración del
complejo enzima-sustrato es constante.
Para determinar la velocidad máxima de una reacción enzimática, la concentración
de sustrato [S] se aumenta hasta alcanzar una velocidad constante de formación
de producto. Esa es la velocidad máxima (Vmax) de la enzima. En ese caso, los
sitios activos de la enzima están saturados con sustrato.
Diagrama de velocidad de reacción y constante de Michaelis-Menten.
La velocidad V indica el número de reacciones por segundo que son catalizadas
por una enzima. Con concentraciones crecientes de sustrato [S], la enzima va
acercándose asintóticamente su velocidad máxima Vmax, pero nunca la alcanza.
Por esta razón, no hay un [S] determinado para la Vmax. De todas formas, el
parámetro característico de la enzima está definido por la concentración de
sustrato a la cual se alcanza la mitad de la velocidad máxima (Vmax/2).
Constante y ecuación de Michaelis-menten
Entonces, aunque la concentración de sustrato a V max no puede ser medida
exactamente, las enzimas pueden ser caracterizadas por la concentración de
sustrato a la cual la velocidad de reacción es la mitad de la velocidad máxima.
Esta concentración de sustrato se conoce como constante de Michaelis-Menten
(KM).
Esta constante representa (para enzimas que exhiben una cinética de Michaelis-
Menten simple), la constante de disociación (la afinidad del complejo enzima-
sustrato (ES) por el sustrato). Valores bajos indican que el complejo ES está unido
35](https://image.slidesharecdn.com/quimicabiologica-111022194610-phpapp02/85/biomoleculas-umsnh-35-320.jpg)
![PROTEINAS Capítulo III
muy fuertemente y raramente se disocia sin que el sustrato reaccione para dar
producto.
Así para estos casos, se obtendrá una diferente KM, según el sustrato específico,
en que actúe cada enzima (como sucede en el caso de enzimas que actúan en
sustratos análogos); y las condiciones de reacción en que se realice las
mediciones.
VMax [s]
V=
Km + [s]
Donde V es la velocidad de reacción, Km es la constante de Michaelis-Menten,
Vmax es la velocidad máxima, y [S] es la concentración de sustrato.
Lineweaver-Burk
El diagrama de Lineweaver-Burk se emplea como herramienta gráfica para
calcular los parámetros cinéticos de una enzima.
Su utilidad consiste en que el recíproco de la cinética de Michaelis-Menten es
fácilmente representable y que de él emanan mucha información de interés.
Cuyo recíproco es:
Donde V es la velocidad de reacción, Km es la constante de Michaelis-Menten,
Vmax es la velocidad máxima, y [S] es la concentración de sustrato.
36](https://image.slidesharecdn.com/quimicabiologica-111022194610-phpapp02/85/biomoleculas-umsnh-36-320.jpg)

![PROTEINAS Capítulo III
1/V E+I
E+S
1/[s]
Inhibicion competitiva
Inhibición no competitiva: la unión del inhibidor con la enzima se realiza en un sitio
diferente a su centro activo; el inhibidor puede reaccionar con la enzima libre o con
el complejo enzima-sustrato. Una inhibición no competitiva se presenta, con
frecuencia, en enzimas que contienen grupos -SH.
1/V E+I
E+S
1/[s]
Inhibicion no competitiva
Inhibición acompetitiva: el inhibidor reacciona solamente con el complejo enzima-
sustrato. Este tipo de inhibiciones se presentan frecuentemente en reacciones bi-
sustrato; es muy poco frecuente en reacciones de un solo sustrato.
38](https://image.slidesharecdn.com/quimicabiologica-111022194610-phpapp02/85/biomoleculas-umsnh-38-320.jpg)
![PROTEINAS Capítulo III
1/V E+I
E+S
1/[s]
Inhibicion acompetitiva
Regulación enzimática
El metabolismo consiste en una serie de reacciones catalizadas por enzimas,
donde los productos de una reacción se convierten en los reactivos de la
siguiente, lo que se conoce como vías metabólicas. Las células deben poder
regular estas vías metabólicas y lo hacen a través de reguladores enzimáticos.
Los inhibidores naturales regulan el metabolismo mientras que los artificiales son
utilizados por la medicina, para destruir plagas, etc.
39](https://image.slidesharecdn.com/quimicabiologica-111022194610-phpapp02/85/biomoleculas-umsnh-39-320.jpg)


























![EJERCICIOS Capítulo VII
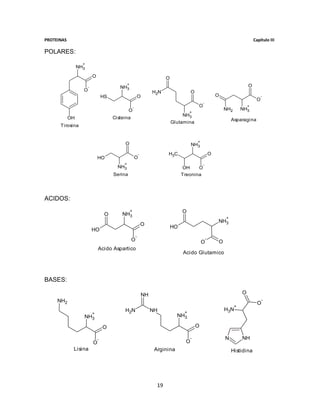
Aminoácidos:
1.- Si una solución que contiene 3 moles de valina está a pH= 4, calcula sus
concentraciones.
Si la solución se encuentra a un pH= 4, esto indica que el carboxilo de la forma
zwterionica es el que reacciona produciéndose la forma cationica, por lo que el pK
que utilizaremos es el pK 1 que corresponde al carboxilo del aminoácido, el cual es
pK1= 2.2.
Primero obtendremos la relación entre las dos formas a partir de la formula:
[prod]
pH= pKa + Log
[reac]
De la cual realizamos un despejamos [prod]/ [reac]:
[prod] [P]
Log ( pH - pKa)
= pH - pKa por lo tanto = 10
[reac] [R]
Por lo que:
[P] ( 4 - 2.2 )
pH = 4 = 10 63.09
[R] =
1
Una vez obtenida la relación se realiza una regla de tres para obtener la
concentración de cada forma presente del aminoácido:
63.095 A 1 B = 64.095 63.095 64.095
X 3
X= 2.953 A
Sea A= forma zwterionica
= 0.047 B
Sea B= forma cationica
De acuerdo al resultado obtenido se tiene que 2.953 moles corresponden a la
forma zwterionica, mientras que 0.047 moles corresponden a la forma cationica
del aminoácido.
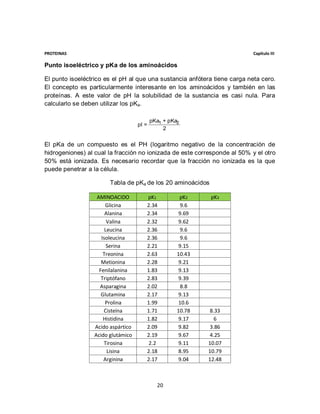
2.- Determinar el pH de una solución que contiene valina, si la relación entre
la forma anionica y zwterionica es 0.9459.
Primero observamos el enunciado, el cual nos indica que la reacción se realiza
entre la forma aninionica y la zwterionica por lo que el pK que está involucrado en
ella es el pK2, correspondiente al grupo amino del aminoácido que es de 9.1.
70](https://image.slidesharecdn.com/quimicabiologica-111022194610-phpapp02/85/biomoleculas-umsnh-70-320.jpg)
![EJERCICIOS Capítulo VII
Utilizando la fórmula para obtener pH, solo sustituimos los valores indicados en
ella, como se muestra a continuación.
pH = pKa + Log [ P ] sustituyendo pH = 9.1 + Log 0.9459 = 9.07
[R]
El pH de la solución de acuerdo al resultado es de 9.07 que demuestra que le
acción se está llevando a cabo entre las dos formas mencionadas al inicio.
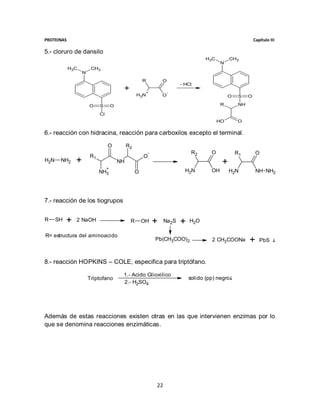
3.- Dado el siguiente péptido que está constituido por:
Ser-Glu-Pro-Met-Ala-Pro-Val-Glu-Tir-Pro-Lis
a) Cuantos péptidos se producirán si se trata con bromuro de cianógeno,
tripsina y quimiotripsina a pH=12.
b) Si solamente se tratara con Termolisina.
Para resolver este enunciado tendremos que utilizar nuestra tabla donde se
muestran las enzimas y reactivos que rompen cadenas de aminoácidos para saber
donde cortaran según lo indicado en el problema:
1.- primero tenemos que se aplica bromuro de cianógeno el cual en metionina
cuando este es uno por lo que se nos forman 2 péptidos uno de 4 aa y uno de 7 ya
que corta entre metionina y alanina.
Ser-Glu-Pro-Met Ala-Pro-Val-Glu-Tir-Pro-Lis
2.- en segundo paso se adiciona tripsina la cual corta a lisina o arginina cuando es
1 por lo que esta no produce cambio ya que no existe arginina en la cadena
polipeptídica y la lisina es ultimo en el heptapeptido.
3.- finalmente se agrega quimiotripsina a pH=12 por lo que corta en Isoleucina,
Valina, Triptófano o Histidina cuando son 1. Por lo que observando nuestros dos
péptidos se realizara un corte entre la valina y el glutamato quedando finalmente
tres restos peptídicos formados por:
Un tetrapeptido formado de Ser-Glu-Pro-Met
Un tripéptido formado por Ala-Pro-Val
Y un tetrapeptido formado por Glu-Tir-Pro-Lis
Para resolver el inciso b se inicia con la cadena polipeptídica inicial donde nos
indica que al suministrar la Termolisina puede realizar cortes en Fenilalanina,
tirosina, triptófano, leucina, isoleucina y valina cuando son 2. Por lo que realiza
71](https://image.slidesharecdn.com/quimicabiologica-111022194610-phpapp02/85/biomoleculas-umsnh-71-320.jpg)




