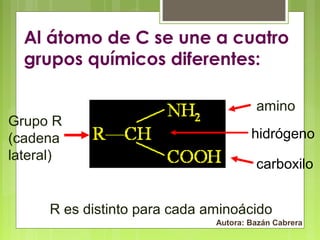
El documento describe las características y estructura de las proteínas. Las proteínas están formadas por cadenas de aminoácidos unidos por enlaces peptídicos. Tienen estructura primaria, secundaria, terciaria y en algunos casos cuaternaria. Cumplen funciones como catalizadoras, estructurales, de transporte, reguladoras e inmunológicas entre otras. Se clasifican por su solubilidad y composición en proteínas simples y conjugadas.