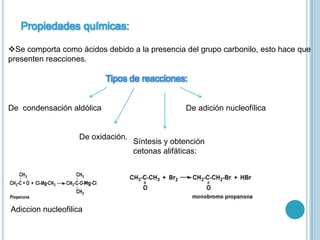
El documento resume las propiedades y usos de las cetonas. Explica que las cetonas contienen un grupo carbonilo y terminan en "-ona". Se usan como disolventes industriales y en perfumes. La acumulación excesiva de cetonas en la sangre puede causar cetoacidosis diabética, una complicación potencialmente mortal de la diabetes.