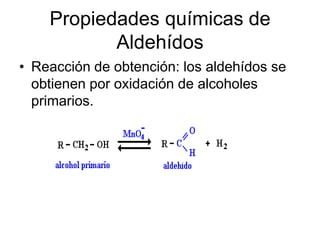
Los aldehídos y cetonas son compuestos orgánicos que contienen un grupo funcional carbonilo, siendo los aldehídos reactivos que se forman por la oxidación de alcoholes primarios y se caracterizan por su solubilidad en agua y olores penetrantes. Las cetonas, obtenidas por oxidación de alcoholes secundarios, son más estables, presentan distintos olores y se utilizan en la industria como disolventes y en aromas naturales. Ambas clases de compuestos tienen nomenclaturas específicas y propiedades físicas y químicas que las distinguen.





![• Prueba de Tollens: también se utiliza para
diferencia cetonas con aldehídos.
Si se mezcla un aldehído con una disolución de
nitrato de plata en amoniaco, se forma un complejo
de plata amoniacal ([Ag(NH3)2]+)
El aldehído se oxida a ácido y la plata se reduce
a metal Esta reacción no se produce con las
cetonas.](https://image.slidesharecdn.com/aldehdosycetonasfinal-131013091038-phpapp01/85/Aldehidos-y-Cetonas-7-320.jpg)



![• Las cetonas se pueden oxidar para formar ésteres en la Oxidación de BaeyerVilliger.
La reacción de cetonas [1] con perácidos [2] produce ésteres [3]. El oxígeno del
perácido se inserta entre el carbono carbonilo y el carbono alfa de la cetona](https://image.slidesharecdn.com/aldehdosycetonasfinal-131013091038-phpapp01/85/Aldehidos-y-Cetonas-11-320.jpg)

