aldeidos y cetonas.pptx
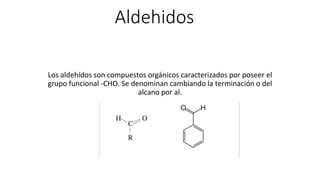
- 1. Aldehidos Los aldehídos son compuestos orgánicos caracterizados por poseer el grupo funcional -CHO. Se denominan cambiando la terminación o del alcano por al.
- 2. • La fórmula general condensada para un aldehido se abrevia como • R – CHO . • NOMENCLATURA DE ALDEHIDOS • Para nombrar los aldehidos, la “o” final del nombre del alcano respectivo se sustituye por el sufijo “al”. Para los miembros inferiores de la familia predomina el empleo de los nombres • comunes como por ejemplo: • Metanal o formaldehido, HCHO; • Etanal o acetaldehido, CH3 – CHO; • Propanal o propionaldehido, CH3 – CH2 – CHO; • Butanal o butiraldehido, CH3 – CH2 – CH2 – CHO; • ventanal o valeraldehido, CH3 – CH2 – CH2 – CH2 - CHO y • benzaldehido, C6H5 - CHO
- 3. NOMENCLATURA DE LOS ALDEHIDOS • Cuando el aldehído presenta radicales se selecciona la cadena principal del hidrocarburo. Se cuenta la cadena a partir del grupo funcional. Se escribe la posición y los radicales correspondientes, Se escribe el nombre de la cadena principal con terminación al.
- 4. NOMENCLATURA DE LOS ALDEHIDOS • Cuando la cadena contiene dos funciones aldehído se emplea el sufijo-dial.
- 5. • Reacciones de Oxidación de Alcoholes. Los alcoholes primarios pueden oxidarse a aldehídos. Estas oxidaciones se presentan en la forma siguiente:
- 6. • Adición de alcoholes. • Los aldehídos reaccionan con los alcoholes en presencia de ácido clorhídrico (catalizador), formando un compuestos de adición inestable, llamado hemiacetal, que, por adición de otra molécula de alcohol, forma un acetal, estable:
- 7. PROPIEDADES FISICAS DE ALDEHIDOS • El primer aldehído es un gas, casi todos los aldehídos son líquidos. Los miembros inferiores son de olor agradable, muchos otros se emplean en la fabricación de perfumes y sabores artificiales. El formaldehído y el acetaldehído son infinitamente solubles en agua, los homólogos superiores no son hidrosolubles. Los aldehídos son menos densos que el agua e incoloros.
- 8. PROPIEDADES QUIMICAS DE LOS ALDEHIDOS • Por su mayor electronegatividad, el oxígeno atrae el par electrónico mas hacia él alejándolo del carbono. En consecuencia, la distribución electrónica del enlace no resulta simétrica; el oxígeno es ligeramente negativo y el carbono ligeramente positivo. El grupo carbonilo puede representarse como dos formas resonantes, una neutra y otra con doble carga de la siguiente manera:
- 9. OBTENCION DE ALDEHÍDOS • Los aldehídos se obtienen mediante la oxidación moderada de alcoholes primarios. • Se puede obtener aldehídos por deshidrogenación catalítica de alcoholes primarios.
- 10. OXIDACIÓN DE ALDEHIDOS • Los aldehídos oxidan fácilmente y se convierten en el ácido carboxílico respectivo, en contraste con las cetonas que son difíciles de oxidar, en presencia de los agentes oxidantes habituales de gran poder como el permanganato de potasio, dicromato de potasio y otros:
- 11. Reactivo de Fehling • ∗ El reactivo de Fehling permite determinar la presencia de aldehídos en una muestra desconocida. Se prepara de tal manera que es una mezcla de color azul que al añadirla a una muestra desconocida oxida a los grupos aldehídos y como resultado positivo de la prueba se observa un precipitado de color rojo ladrillo de óxido cuproso.
- 12. PRINCIPALES ALDEHIDOS • El formaldehído es un gas incoloro y de olor extremadamente irritante. Se disuelve en agua en soluciones del 37 al 40 % (Formol). Es germicida, astringente, antiséptico y fungicida. • La conservación de cadáveres con formaldehído depende mas de efecto antimicrobiano que el endurecimiento de los tejidos (se conjuga con las proteínas)
- 13. FORMALDEHIDO EN EL AMBIENTE • La mayor parte del formaldehído se encuentra en el aire. El formaldehído se disuelve fácilmente en agua, pero no permanece en el agua mucho tiempo y se le detecta en suministros de agua potable. La mayor parte del formaldehído en el aire se degrada durante el día. Entre los productos de degradación del formaldehído en el aire están el ácido fórmico y el monóxido de carbono. El formaldehído no parece acumularse en plantas o animales y, aunque se encuentra en algunos alimentos, las cantidades que se encuentran son pequeñas. • El cloral es el tricloroacetaldehído, aceite inestable y desagradable por lo cual se introdujo en medicina en forma de hidrato de cloral, CCl3 – CH(OH)2. Se utiliza en la síntesis del DDT y es el mas antiguo de los hipnóticos. Es muy irritante a la piel y a la mucosa • ∗ El paraldehido es un compuesto cíclico que se forma por la adición nucleofílica de tres moléculas de acetaldehído. Es un líquido incoloro, de aroma fuerte y desagradable. Es un hipnótico de acción rápida. Es eficaz en convulsiones experimentales y se ha empleado en el tratamiento urgente del tétano, eclampsia, epilepsia y envenenamiento por medicamentos convulsionantes
- 14. Cetonas • Los cetonas son compuestos que presentan un grupo carbonilo localizado en los carbonos intermedios de la cadena
- 15. NOMENCLATURA • En la nomenclatura de cetonas para nombrarlas se toma en cuenta el número de átomos de carbono y se cambia la terminación por ONA, indicando el carbono que lleva el grupo carbonilo (CO). Además se debe tomar como cadena principal la de mayor longitud que contenga el grupo carbonilo y luego se enumera de tal manera que éste tome el localizador más bajo.
- 16. NOMENCLATURA DE LAS CETONAS • Cuando la cetona presenta radicales, se cuenta la cadena principal a partir del extremo más cercano al grupo carbonilo. Se escribe la posición y los radicales correspondientes, seguido de la posición del grupo carbonilo y al final el nombre de la cadena principal con terminación ona.
- 17. NOMENCLATURA DE LAS CETONAS • ∗ Existe un segundo tipo de nomenclatura para las cetonas, que consiste en nombrar las cadenas como sustituyentes, ordenándolas alfabéticamente y terminando el nombre con la palabra cetona.
- 18. PROPIEDADES FISICAS • Los compuestos carbonílicos presentan puntos de ebullición más bajos que los alcoholes de su mismo peso molecular. No hay grandes diferencias entre los puntos de ebullición de aldehídos y cetonas de igual peso molecular. • Los compuestos carbonílicos de cadena corta son solubles en agua y a medida que aumenta la longitud de la cadena disminuye la solubilidad. • ∗ Las primeras cetonas son líquidas, a partir de la cetona que presenta 16 átomos de carbono son sólidos. Presentan por lo general olor agradable. Son solubles en alcohol, éter y cloroformo.
- 19. PROPIEDADES QUIMICAS • Al hallarse el grupo carbonilo en un carbono secundario son menos reactivas que los aldehídos. Sólo pueden ser oxidadas por oxidantes fuertes como el permanganato de potasio, dando como productos dos ácidos con menor número de átomos de carbono. Por reducción dan alcoholes secundarios. • No reaccionan con el reactivo de Tollens para dar el espejo de plata como los aldehídos, lo que se utiliza para diferenciarlos. Tampoco reaccionan con los reactivos de Fehling y Schiff.
- 20. OBTENCIONES DE CETONAS • Se puede obtener cetonas a partir de la oxidación moderada de alcoholes de secundarios. • Se pueden obtener cetonas mediante la deshidrogenaciín de alcoholes secundarios.
- 21. CETONAS IMPORTANTES • La acetona, es un líquido transparente, e incoloro, de olor agradable pero penetrante, es flamable y es soluble en agua. Se usa como disolvente en quitaesmalte para uñas y como producto para la elaboración de cloroformo y yodoformo así como de ciertas esencias usadas en perfumería. Entre las cetonas superiores más importantes están la etil-metil-cetona ( se usa en removedores de pintura) y la metil-isobutil-cetona, utilizadas en la preparación de disolventes industriales
- 23. DEFINICIÓN • Son compuestos orgánicos en los que un átomo de oxigeno se une directamente a dos radicales alquilo( RO-R`), dos radicales arilo (Ar-O- Ar`) o un radical arilo y otro alquilo ( Ar-O-R).
- 24. CLASIFICACIÓN • De acuerdo con la naturaleza de los radicales, se clasifican en: • A- Éteres simples: cuando los dos radicales son iguales. • B- Éteres mixtos: si los radicales difieren en el numero de átomos de carbono • C- Éteres aromaticos: cuando tienen radicales aromaticos. • D- Éteres aromático-alifatico: cuando un radical es aromático y el otro alifático
- 25. NOMENCLATURA • Los éteres pueden nombrarse como alcoxi derivados de alcanos (nomenclatura IUPAC sustitutiva). Se toma como cadena principal la de mayor longitud y se nombra el alcóxido como un sustituyente.
- 26. • Regla 2. La nomenclatura funcional (IUPAC) nombra los éteres como derivados de dos grupos alquilo, ordenados alfabéticamente, terminando el nombre en la palabra éter.
- 27. PROPIEDADES • Los éteres presentan unos puntos de ebullición inferiores a los alcoholes, aunque su solubilidad en agua es similar. Dada su importante estabilidad en medios básicos, se emplean como disolventes inertes en numerosas reacciones. • La importante solubilidad en agua se explica por los puentes de hidrógeno que se establecen entre los hidrógenos del agua y el oxígeno del éter. • En contacto con el aire sufren una lenta oxidación en la que se forman peróxidos muy inestables y poco volátiles. Estos constituyen un peligro cuando se destila un éter, pues se concentran en el residuo y pueden dar lugar a explosiones. • Esto se evita guardando el éter con hilo de sodio o añadiendo una pequeña cantidad de un reductor (SO4Fe, LiAIH4) antes de la destilación .
- 28. PRINCIPAL ETER CONTAMINANTE • Metil terc butil eter • Es utilizado como aditivo en la gasolina. Su fórmula química es C5H12O y su peso molecular de 88.15 g/mol. • Es un líquido incoloro relativamente volátil y muy poco soluble en agua. • Es muy soluble en algunos solventes orgánicos como el alcohol y éter. • Respirar aire contaminado con este químico causa irritación del sistema respiratorio, vértigos y desorientación.
- 29. Éter de pentabromodifenilo C12H5Br5O • El pentaBDE se encuentra en artículos de uso doméstico, tales como muebles, alfombras y electrodomésticos, diversos estudios han evaluado la exposición al polvo del aire con contenido de pentaBDE en interiores. • El pentaBDE se libera al aire, al agua y al suelo, siendo el mayor destinatario, el suelo. • La distribución entre los compartimientos ambientales es: suelo>>>agua>aire. En su mayor parte, el pentaBDE se halla en el medio ambiente unido a partículas: sólo una pequeña cantidad se transporta en su fase gaseosa, o diluido en agua; sin embargo, este transporte, a lo largo de períodos prolongados, puede ser eficaz para distribuir el pentaBDE ampliamente en el medio ambiente, en especial hacia las regiones árticas.
- 30. ACIDOS CARBOXILICOS • Los ácidos carboxílicos son moléculas en las que el carbono, que se encuentra en un extremo de ella, está enlazado con un grupo -OH y un oxígeno a través de un doble enlace como se muestra en la figura. • Los ácidos carboxílicos se clasifican de acuerdo con el sustituyente unido al grupo carboxilo. Un ácido alifático tiene un grupo alquilo unido al grupo carboxilo, mientras que un ácido aromático tiene un grupo arilo.
- 31. NOMENCLATURA • El nombre de los ácidos carboxílicos comienza con la palabra “ácido” seguida por el nombre del alcano básico terminado en “oico”. Para los ácidos alifáticos, el carbono uno corresponde al carbono carboxilo. Los ácidos mas frecuentes se conocen por sus nombres comunes, por ejemplo Ácido metanoico o fórmico, HCOOH; Ácido etanoico o Ácido acético, CH3 - COOH; Ácido propanoico o propiónico, CH3 - CH2 - COOH; Ácido butanoico o butírico, CH3 - CH2 - CH2 - COOH.
- 32. PROPIEDADES FÍSICAS • Puntos de Fusión. • Los ácidos carboxílicos que contienen más de ocho átomos de carbono, por lo general son sólidos, a menos que contengan dobles enlaces. La presencia de dobles enlaces en una cadena larga impide la formación de una red cristalina estable, lo que ocasiona un punto de fusión más bajo.Los puntos de fusión de los ácidos dicarboxílicos son muy altos. Teniendo dos carboxilos por molécula , las fuerzas de los puentes de hidrógeno son especialmente fuertes en estos diácidos: se necesita una alta temperatura para romper la red de puentes de hidrógeno en el cristal y fundir el diácido.
- 33. PROPIEDADES FISICAS Solubilidad • Los ácidos carboxílicos forman puentes de hidrógeno con el agua, y los de peso molecular más pequeño (de hasta cuatro átomos de carbono) son miscibles en agua. A medida que aumenta la longitud de la cadena de carbono disminuye la solubilidad en agua; los ácidos con más de diez átomos de carbono son esencialmente insolubles. Los ácidos carboxílicos son muy solubles en los alcoholes, porque forman enlaces de hidrógeno con ellos. Además, los alcoholes no son tan polares como el agua, de modo que los ácidos de cadena larga son más solubles en ellos que en agua. La mayor parte de los ácidos carboxílicos son bastante solubles en solventes no polares como el cloroformo porque el ácido continua existiendo en forma dimérica en el solvente no polar.
- 34. PROPIEDADES QUIMICAS • Acidez • La reacción más característica de los ácidos carboxílicos es su ionización
- 35. PROPIEDADES QUIMICAS • Esta ionización se atribuye al desplazamiento electrónico a lo largo del doble enlace del grupo carbonilo hacia el átomo de oxígeno, dejando una carga positiva parcial sobre el átomo de carbono, provocando un desplazamiento inductivo a lo largo de los enlaces C - O y O - H, en sentido opuesto al átomo de hidrógeno, que puede ser extraído por interacción con una base. Por otra parte, el anión producido por la pérdida de un protón es un híbrido de resonancia de dos estructuras canónicas. La deslocalización de la carga estabiliza el anión, por lo que este puede formarse con mayor facilidad Ácidos Carboxílicos
- 36. PROPIEDADES QUIMICAS • Entre los ácidos alifáticos monocarboxílicos a medida que aumenta el número de carbonos disminuye su acidez porque los grupos hidrocarbonados son donadores de electrones, lo que hace que a mayor número de carbonos se fortalezca el enlace O - H y disminuye la facilidad de la liberación del ión hidrógeno.
- 37. REACCIÓN DE NEUTRALIZACIÓN • FORMACIÓN DE UN ESTER • Los ácidos carboxílicos sencillos son ácidos débiles que al reaccionar con bases fuertes, como el hidróxido de sodio, originan sales estables que son sólidos solubles en agua y se hallan completamente disociadas en solución. A las sales orgánicas se les nombra de la misma manera que a las sales inorgánicas. Al nombre del anión orgánico le sigue el nombre del catión. El nombre del anión se obtiene eliminando la terminación “ico” de los ácidos y reemplazándola por la terminación “ato”EjemploEl acetato de sodio, CH3 - COONa
- 38. Reacción de los ácidos carboxílicos con amoniaco-FORMACIÓN DE AMIDAS • Los ácidos carboxílicos reaccionan con el amoniaco formando amidas, en una reacción muy lenta a la temperatura ambiente. Primero se forma la sal de amonio y se separa el agua si la reacción se mantiene por encima de los 100 ºC. La ecuación general es:
- 39. Formación de nitrilos • Los nitrilos se consideran derivados de los ácidos carboxílicos puesto que tienen el mismo estado de oxidación. Su fórmula general es R -CN y se nombran como ésteres del ácido cianhídrico o como cianoderivados de los hidrocarburos. Por ejemplo, el propionitrilo o cianuro de n-propilo es de fórmula CH3 - CH2 - CH2 – CN
- 40. TOXICIDAD DE NITRILOS • Los nitrilos son sólidos o líquidos neutros. Los nitrilos alifáticos de pocos átomos de carbono son solubles en agua. Son compuestos covalentes y su toxicidad no es tan elevada como la de los cianuros iónicos, ya que no producen ácido cianhídrico por hidrólisis. La hidrólisis ácida de los nitrilos produce, primero, la amida correspondiente y, si prosigue, se obtiene el correspondiente ácido carboxílico.
- 41. ACIDOS MAS IMPORTANTES • Ácido acrílico, nombre común en química para el ácido propénico, CH2=CH-COOH. • Ácido benzoico, sólido de fórmula C6H5—COOH. • Ácido fumárico, es el ácido trans-butenodioico, compuesto cristalino incoloro, de fórmula HO2CCH=CHCO2H. • Ácido linoleico, líquido oleoso, incoloro o amarillo pálido, de fórmula CH3(CH2)4(CH=CHCH2)2(CH2)6CO2H. El ácido linoleico es un ácido graso esencial, es decir, es un elemento necesario en la dieta de los mamíferos por ser uno de los precursores de las prostaglandinas y otros componentes de tipo hormonal.Se encuentra como éster de la glicerina en muchos aceites de semillas vegetales, como los de linaza, soja, girasol y algodón. Se utiliza en la fabricación de pinturas y barnices • ACIDOS MAS IMPORTANTES Ácido oleico, líquido oleoso e incoloro, de fórmula CH3(CH2)7CH=CH(CH2)7CO2H. No es soluble en agua, pero sí en benceno, alcohol, éter y otros muchos disolventes orgánicos. • Ácido esteárico, sólido orgánico blanco de apariencia cristalina, de fórmula CH3(CH2)16COOH. No es soluble en agua, pero sí en alcohol y éter. Se utiliza en mezclas lubricantes, materiales resistentes al agua, desecantes de barnices, y en la fabricación de velas de parafina. • Combinado con hidróxido de sodio el ácido esteárico forma jabón (estearato de sodio). Ácido láctico o Ácido 2-hidroxipropanoico, compuesto incoloro de fórmula CH3CHOHCOOH. Se da bajo dos formas ópticamente activas, dextrógira y levógira*, frecuentemente denominadas ácido D-láctico y ácido L- láctico. Normalmente se prepara por fermentación bacteriana de lactosa, almidón, azúcar de