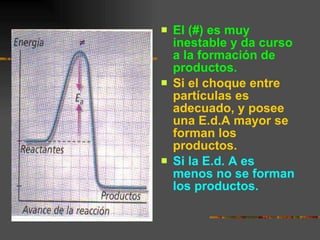
Para que ocurra una reacción química, las partículas deben colisionar con suficiente energía para romper enlaces. La velocidad de reacción depende de factores como la temperatura, concentración, y estado de división de los reactivos, así como la presencia de catalizadores. La energía de activación requerida para alcanzar el estado de transición es responsable de la transformación de los reactivos a los productos.






![2. Concentración La velocidad de R(X)aumentará si elevamos la [ ] de uno de los reactivos, ya que el n° de choques entre atomos es más frecuente. Si se duplica la [Reactivos], la velocidad de la reacción tambien se duplica.](https://image.slidesharecdn.com/cinticaqumica-100806225031-phpapp02/85/Cinetica-quimica-8-320.jpg)


![Velocidad de Reacción Ecuación de Velocidad: A ------ B K= Constante de Velocidad [Concentración de Reactantes] Unidad de medida de Velocidad = M/s](https://image.slidesharecdn.com/cinticaqumica-100806225031-phpapp02/85/Cinetica-quimica-13-320.jpg)
![Ley de Velocidad a A + b B ------ c C + d D La velocidad disminuye a medida que transcurre el proceso, ya que disminuye la [Reactantes ]. La V es proporcional a las [ ] de reactantes.](https://image.slidesharecdn.com/cinticaqumica-100806225031-phpapp02/85/Cinetica-quimica-14-320.jpg)
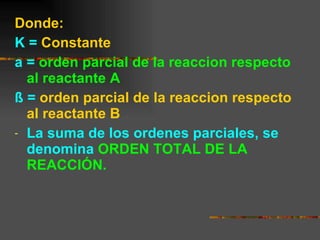
![Ejemplo: I 2 (g) + H 2 (g) ------- 2 HI(g) V = K [ I 2 ] [ H 2 ] a [ I 2 ] = 1 ; ß [ H 2 ] = 1 Orden de la Reacción (a + ß) es 2 (Reaccion de Segundo Orden)](https://image.slidesharecdn.com/cinticaqumica-100806225031-phpapp02/85/Cinetica-quimica-16-320.jpg)
![Representación Gráfica del Orden de Reacción Dependencia de la velocidad con la concetración del reactante: Reacción de Orden 0 : En este caso la Velocidad no depende de la [Reactantes].](https://image.slidesharecdn.com/cinticaqumica-100806225031-phpapp02/85/Cinetica-quimica-17-320.jpg)
![b) Reacción de Orden 1: La velocidad aumenta linealmente con la [Reactantes], la velociadad es directamente proporcional a la [ ].](https://image.slidesharecdn.com/cinticaqumica-100806225031-phpapp02/85/Cinetica-quimica-18-320.jpg)
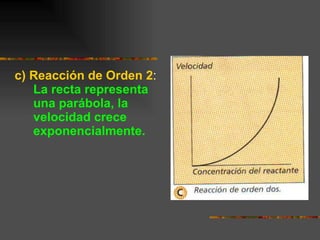
![Ejercicios Calcular la velocidad de Reacción: O 3 (g) + O(g) ------ 2 O 2 (g) K = 8 * 10 5 [O 3 ] = 1,25 * 10 –7 M [O] = 1,0 * 10 –5 M V = K [O 3 ] [O] Resp : V = 1 * 10 –6 M/s](https://image.slidesharecdn.com/cinticaqumica-100806225031-phpapp02/85/Cinetica-quimica-20-320.jpg)