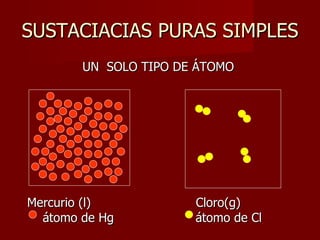
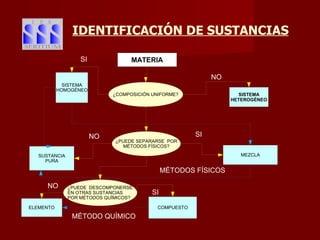
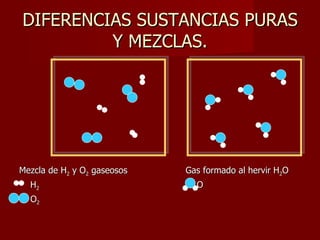
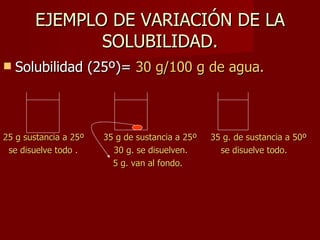
Este documento clasifica los diferentes tipos de materia, incluyendo sustancias puras, mezclas, disoluciones y coloides. Explica que las sustancias puras contienen un solo componente, mientras que las mezclas contienen dos o más componentes. También describe varios métodos para separar mezclas heterogéneas y homogéneas, y los factores que afectan la solubilidad de las sustancias en las disoluciones, como la temperatura y la agitación.