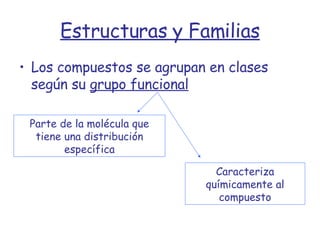
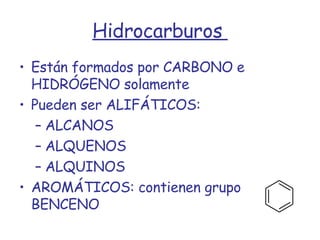
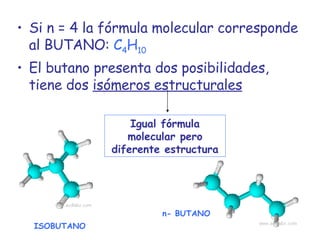
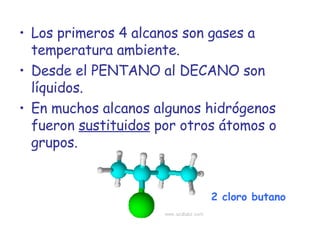
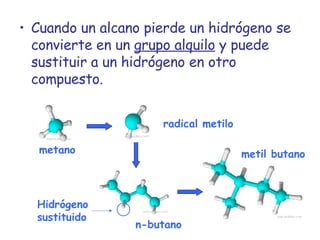
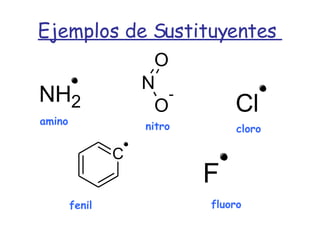
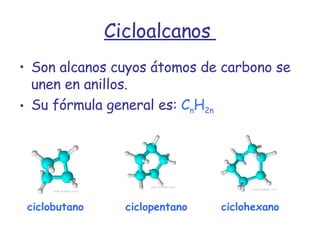
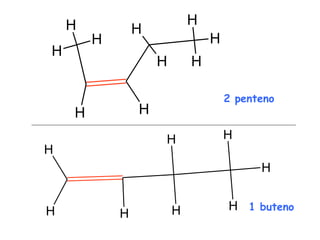
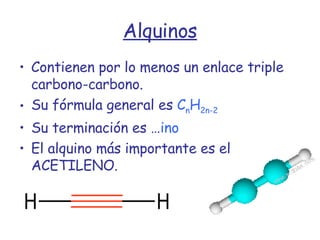
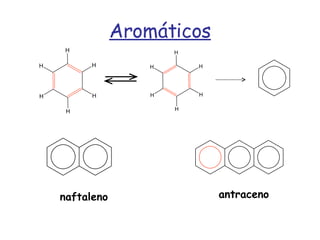
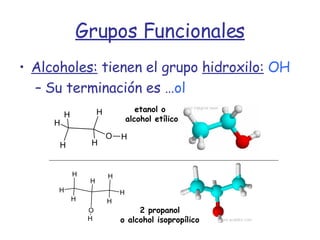
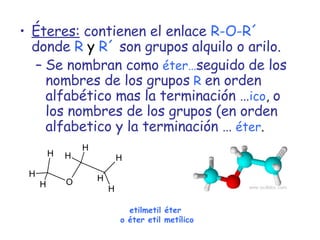
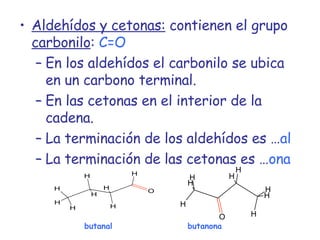
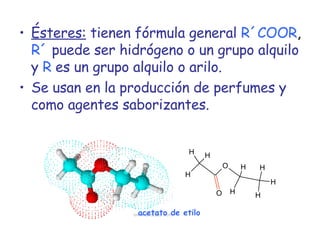
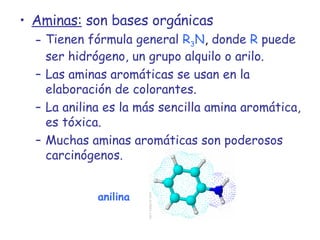
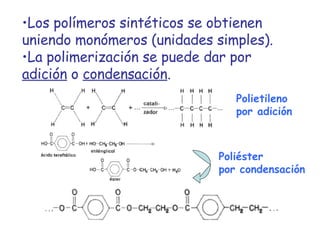
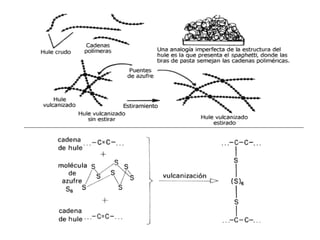
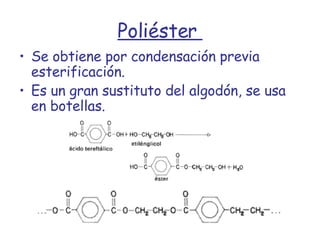
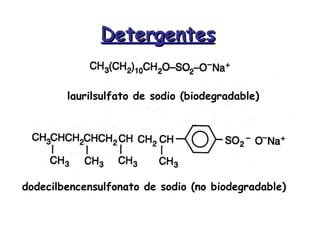
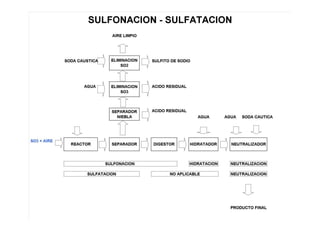
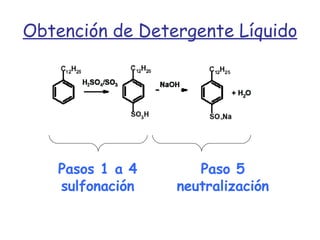
El documento describe los compuestos orgánicos, sus estructuras y reacciones. Explica que están formados principalmente por carbono e hidrógeno, y pueden contener otros elementos. Se clasifican en familias según su grupo funcional, como hidrocarburos, alcoholes, éteres y polímeros. Muchos compuestos orgánicos se usan en industrias como combustibles, medicinas, plásticos y más.