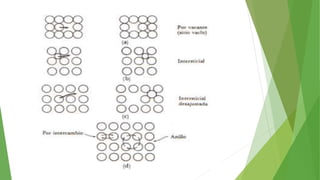
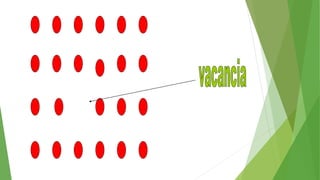
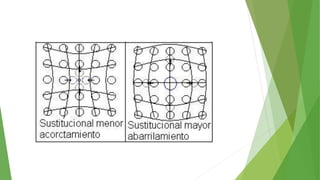
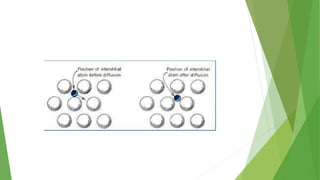
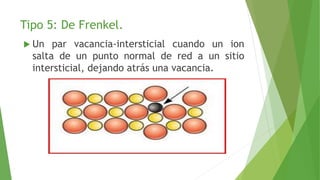
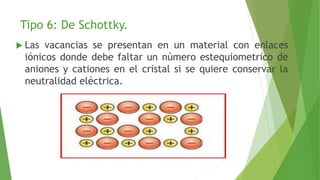
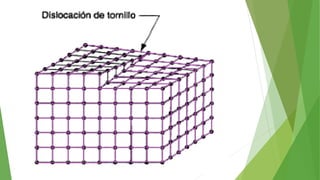
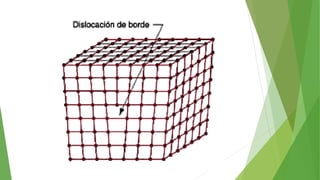
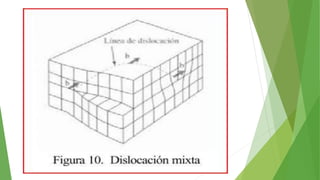
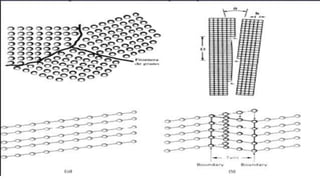
Los defectos en las estructuras cristalinas incluyen defectos puntuales (como vacancias y átomos intersticiales), defectos lineales (como dislocaciones) y defectos de superficie. Estos defectos afectan las propiedades de los materiales y pueden introducirse durante la solidificación, procesamiento o por dopado. Los defectos puntuales incrementan la resistencia mecánica mientras que las dislocaciones permiten la deformación plástica de los metales a través del movimiento de las dislocaciones.