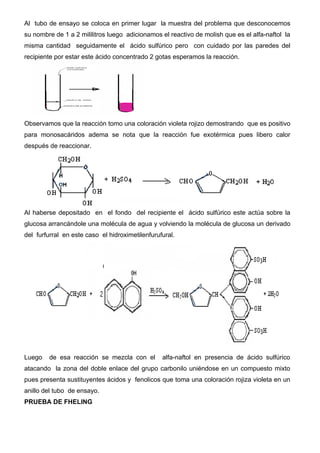
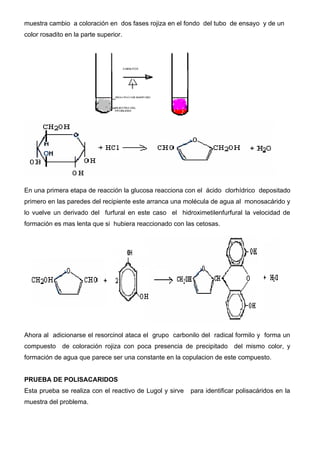
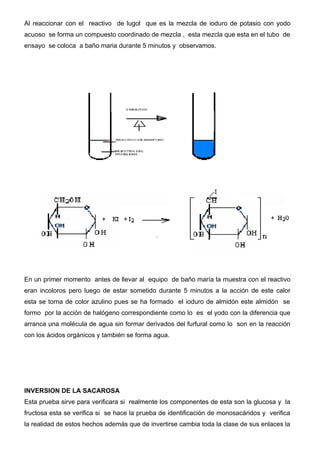
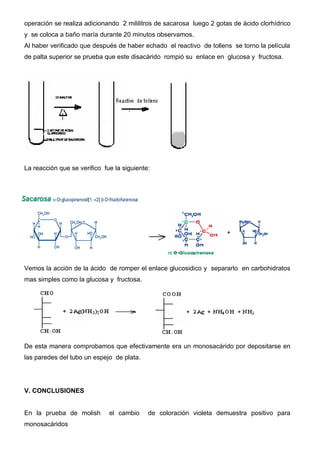
Este documento describe métodos para reconocer monosacáridos, disacáridos y polisacáridos. Explica las pruebas de Molish, Fehling, Tollens, Barfoed y Lugol, las cuales permiten identificar estos carbohidratos mediante las reacciones y cambios de color que ocurren. También define los tipos de monosacáridos, disacáridos, oligosacáridos y polisacáridos, y sus características químicas fundamentales.


![Los oligosacáridos al hidrolizarse dan de tres a seis moléculas de monosacáridos. Así los
trisacáridos están formados por la condensación de tres moléculas de monosacáridos. Por
ejemplo la rafinosa que -D-galactopiranosil [1es →-D-glucopiranosil [1-6] →-D-
fructofuranosido es el-2] azúcar de la remolacha.
Los polisacáridos, también llamados poliósidos o glucanos, están formados por más de 10
residuos de monosacáridos. A continuación, se resumen las características más importantes
de los principales tipos de polisacáridos.
III. MATERIALES Y REACTIVOS
6 tubos de ensayo.](https://image.slidesharecdn.com/descarga-110521181327-phpapp02/85/Descarga-4-320.jpg)