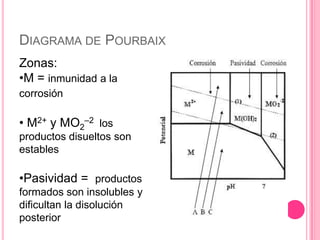
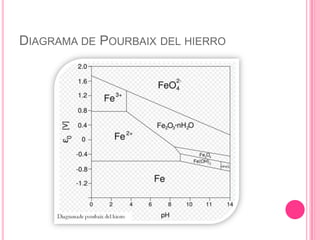
El diagrama de Pourbaix-pH fue creado por el químico ruso Marcel Pourbaix en 1963 para mostrar los equilibrios electroquímicos de los elementos como función del potencial y el pH. Representa las diferentes regiones de inmunidad, pasividad y corrosión de un metal en una solución en función de estas variables. Se calcula usando la ecuación de Nernst para el potencial y trazando líneas horizontales, verticales u oblicuas que representan reacciones que dependen o no del pH y el potencial.



![Como calculamos e interpretamos un diagrama de PourbaixEste se lee en los ejes de X ,Y: -En Y, se encuentra el potencial, el cual calculamos con la eq. de Nernst, h= hidrogeno-En X, se encuentra el pH con la función de –log del H+ concentración de iones pH = − log[H+ ]](https://image.slidesharecdn.com/diagramadepourbaixpresentfinal-110724070802-phpapp02/85/Diagrama-de-pourbaix-present-final-4-320.jpg)