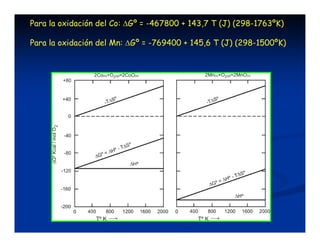
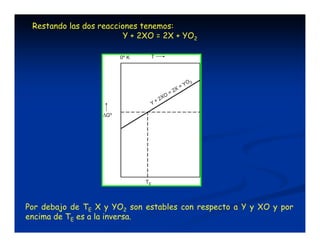
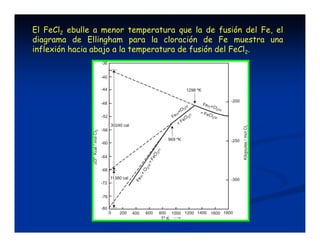
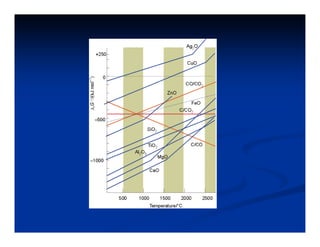
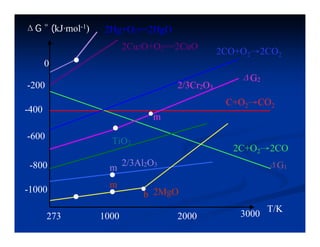
El documento describe los diagramas de Ellingham, que muestran la relación entre la variación de la energía libre estándar (ΔG°) de reacciones de oxidación y la temperatura. Ellingham observó que estas relaciones se aproximaban a rectas en rangos de temperatura donde no ocurrían cambios de fase. Los diagramas permiten predecir la estabilidad termodinámica relativa de óxidos a diferentes temperaturas.