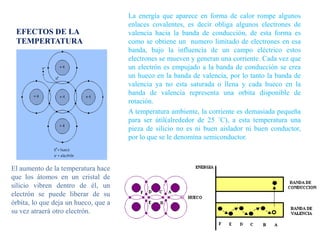
El documento describe la estructura atómica del silicio. El átomo de silicio tiene 14 protones y 14 electrones. 4 electrones se encuentran en la órbita exterior. Cuando los átomos de silicio se combinan, forman una estructura cristalina ordenada unidos por enlaces covalentes donde comparten electrones, dando a cada átomo 8 electrones en su órbita de valencia. La energía térmica puede promover electrones a la banda de conducción, creando huecos en la banda de valencia y permitiendo la conducción eléctrica.