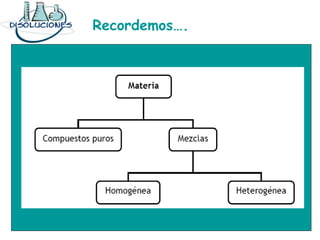
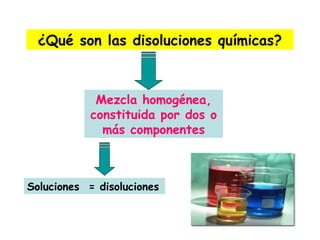
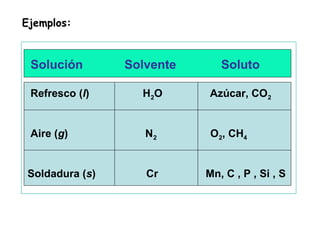
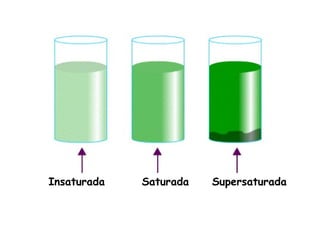
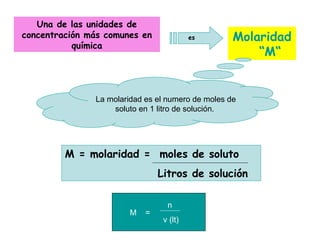
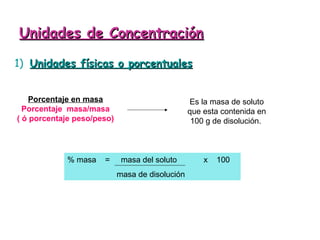
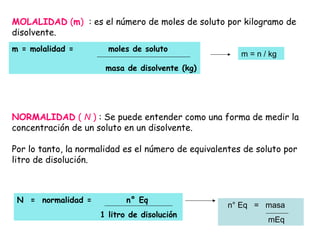
Las disoluciones químicas son mezclas homogéneas compuestas por un soluto y un solvente. El agua es el solvente más común y puede disolver sustancias polares. Las disoluciones se clasifican por su estado físico (sólidas, líquidas o gaseosas) y concentración (diluidas, concentradas o supersaturadas). La concentración de una disolución se puede expresar en unidades como la molaridad, que es el número de moles de soluto por litro de solución.