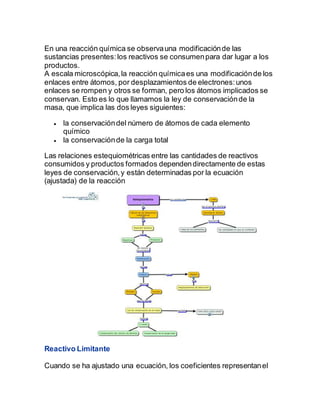
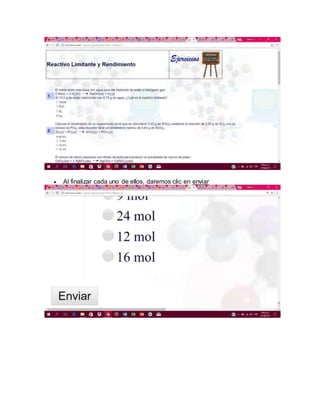
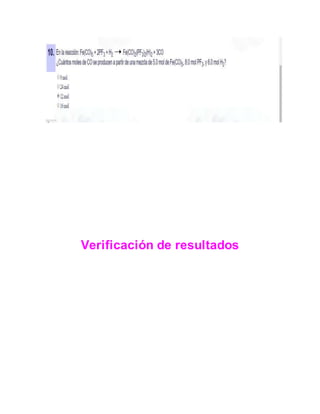
Este documento presenta información sobre estequiometría. Explica conceptos clave como reactivo limitante, rendimiento teórico, y rendimiento real. También describe ejercicios resueltos en una página web sobre cálculos estequiométricos relacionados con reactivos limitantes y rendimientos. El autor concluye que la estequiometría es una herramienta indispensable para procesos químicos ya que permite determinar las masas necesarias de reactivos para obtener un producto deseado.