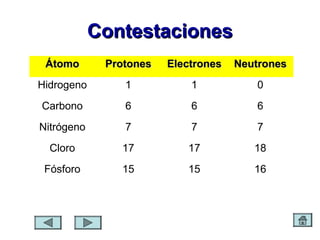
Este documento presenta un módulo instruccional sobre el átomo. El módulo incluye objetivos de aprendizaje, una pre-prueba, contenido sobre la estructura y composición del átomo, ejercicios de práctica, y una post-prueba. El contenido explica que los átomos están compuestos de protones, electrones y neutrones, y que los elementos químicos se representan con símbolos de uno o dos caracteres.