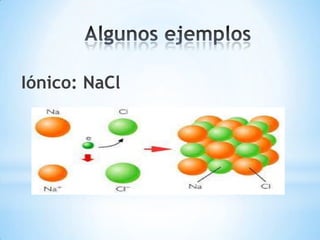
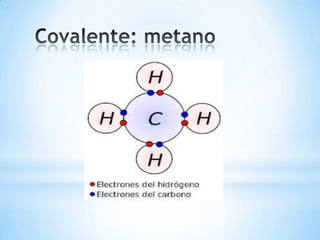
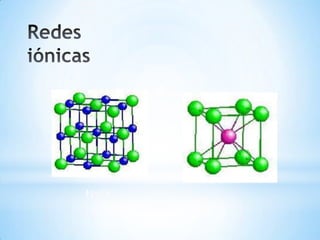
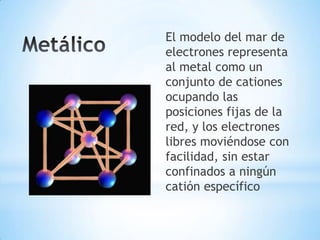
Este documento describe los tres tipos principales de enlaces químicos: iónico, covalente y metálico. Los enlaces iónicos unen metales y no metales a través de la transferencia de electrones, mientras que los enlaces covalentes comparten electrones entre no metales. Los enlaces metálicos implican la liberación de electrones por parte de metales.