ENZIMAS PRINCIPALES EN EL SER HUMANO/ BIOQUÍMICA
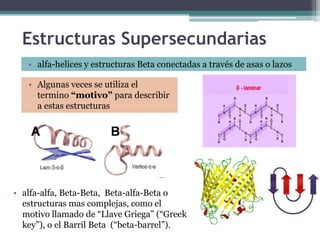
- 1. Estructuras Supersecundarias • alfa-helices y estructuras Beta conectadas a través de asas o lazos • Algunas veces se utiliza el termino “motivo” para describir a estas estructuras • alfa-alfa, Beta-Beta, Beta-alfa-Beta o estructuras mas complejas, como el motivo llamado de “Llave Griega” (“Greek key”), o el Barril Beta (“beta-barrel”).
- 2. Dominios • Son unidades estructurales compactas, estables, dentro de una proteina, formadas por segmentos de una cadena peptidica que se pliegan de forma independiente, con una estructura y funcion distinguible de otras regiones de la proteina y estabilizadas por las mismas fuerzas que la estructura terciaria.
- 3. DIFERENCIAS GLOBULARES FIBROSAS Forma Esferoidal, de ovillo, casi esférica. Longitudinal, alargada. Cadena polipeptídica Plegada. Estirada. Solubilidad Solubles. Insolubles. Función Metabólica, unen moléculas, dinámica. Estructural, estática. Ejemplo Mioglobina, hemoglobina, Insulina Colágeno, Queratina
- 5. TIPO SUB-TIPOS CARACTERÍSTICAS Fibrosas (Insoluble s en agua) Queratinas Se encuentran en el pelo, la piel, uñas, plumas, algodón y lana. Colágenos Son la clase más importante en el tejido conectivo. Son componentes de los tendones, ligamentos, huesos y dientes.. Elastinas Son los componentes de las paredes de los vasos sanguíneos. Globulares (Se dispersan en agua formando coloides) Albúminas Forman parte de la estructura de las moléculas que transportan lípidos a través del entorno acuosa de la sangre Histonas Se encuentran generalmente en las células unidas a las moléculasde DNA. Globulinas Son componentes de enzimas y anticuerpos. PROTEÍNAS SIMPLES
- 6. PROTEÍNAS CONJUGADAS Tipo Características Lipoproteínas Ayudan a suspender y transportar los Iípidos a través del torrente sanguíneo. Glucoproteínas Formadas por carbohidratos o derivados y proteínas. Ejemplo: El interferón es una pequeña glucoproteína producida por las células en respuesta a las infecciones virales: inhibe la reproducción de virus interfiriendo la capacidad de éstos para producir sus propias proteínas Nucleoproteínas Proteínas compuestas de ácidos nucleicos (DNA y RNA) y proteínas Hemoproteínas. Contiene un grupo hemo, además de la parte proteínica de la molécula. Ejemplos: hemoglobina y mioglobina PROTEINA + COMPONENTE NO PROTEICO SIN GPO P: APOPROTEINA CON GPO P: HOLOPROTEINA GRUPO PROSTÉTICO
- 7. ENZIMAS M.C. Norarizbeth Lara Flores
- 8. Las enzimas son proteínas • Catalizan reacciones químicas necesarias para la sobrevivencia celular • Sin las enzimas los procesos biológicos serían tan lentos que las células no podrían existir. • Las enzimas pueden actuar dentro de la célula , fuera de ésta, y en el tubo de ensayo. E + S ESEP E + P E E E E
- 9. La enzima disminuye la energía de activación Tiempo de la reacción E + S E + P Sin enzima Con enzima Es la energía que necesita un sistema antes de poder iniciar un determinado proceso.
- 10. Enzima • la enzima acelera la velocidad de una reacción química. • Una enzima puede transformar 1000 moléculas de sustrato/ segundo • Las enzimas tienen 3 propiedades: ▫ Especificidad por el sustrato ▫ Se inactivan por desnaturalización ▫ Pueden ser reguladas
- 11. • Las enzimas se unen a los reactivos (sustratos) reduciendo la energía de activación • Cada enzima tiene una forma única con un sitio o centro activo en el que se une al sustrato • Después de la reacción, enzimas y productos se separan. • Las moléculas enzimáticas no han cambiado después de participar en la reacción
- 12. Las enzimas cumplen su papel catalítico gracias a: • Fijación estereoquímicamente complementaria del sustrato • Transformación catalítica del mismo En ambas funciones participan: • Cadenas laterales de los aminoácidos • Grupos o moléculas no proteicas: Grupos prostéticos Iones metálicos Cofactores
- 13. Los siguientes hechos: • Especificidad de la reacción enzimática • Carácter homogéneo de la catálisis enzimática Nos llevan a postular la existencia de un Centro Activo en la molécula de enzima, capaz de: • Fijar específicamente al substrato • Transformarlo catalíticamente.
- 15. • Complementariedad geométrica • Complementariedad de cargas, uniones iónicas • Modelos: Encaje inducido Llave – cerradura. Estado de transición La unión del sustrato es muy específica
- 16. Teorías de la acción enzimática, 1 Modelo de Llave y Cerradura (Emil Fischer) Substrato y enzima se acoplan de forma estereospecífica, de la misma manera que una llave se ajusta a su cerradura. Modelo aceptado durante mucho tiempo; hoy se considera insuficiente al no explicar algunos fenómenos de la inhibición enzimática
- 17. Teorías de la acción enzimática, 2 Modelo de Ajuste Inducido (Koshland) Tanto la enzima como el substrato sufren una alteración en su estructura por el hecho físico de la unión. Está mucho más de acuerdo con todos los datos experimentales conocidos hasta el momento.
- 18. Teorías de la acción enzimática, 3 La teoría del Ajuste Inducido se amplía en la actualidad definiendo la acción enzimática como Estabilización del Estado de Transición Según lo cual, el Centro Activo enzimático es en realidad complementario no al substrato o al producto, sino al estado de transición entre ambos.
- 19. Una enzima puede unir dos sustratos en su sitio activo
- 20. Coenzimas • Las coenzimas son pequeñas moléculas orgánicas, que se unen a la enzima. • Las coenzimas colaboran en la reacción enzimática recibiendo transitoriamente algún grupo químico: H+ , OH, CH3 . • La enzima sin la coenzima recibe el nombre de APOENZIMA
- 21. El NAD es una coenzima aceptora de H Sustrato oxidado
- 24. Algunas enzimas requieren metales para mejorar su actividad COFACTOR COFACTOR
- 26. Isoenzimas o Isozimas • Son formas moleculares diferentes de una misma enzima • Catalizan la misma reacción M4, M3H1, M2H2, M1H3 y H4 • Se diferencian por su movilidad electroforética
- 27. EC 2.7.1.1 Número Enzyme Commission: Enzyme Comission Grupo Subgrupo Nombre común (sustrato+”asa”): Hexokinasa Clasificación y nomenclatura ATP: hexosa fosfotransferasa Nombre sistemático: Donador Aceptor Grupo transferido Tipo de reacción catalizada Enzimas
- 28. EC 1. Oxidorreductasas EC 2. Transferasas EC 3. Hidrolasas EC 4. Liasas EC 5. Isomerasas EC 6. Ligasas Clasificación de enzimas por Grupos Clasificación y nomenclatura
- 29. Grupo 1: Oxidorreductasas Catalizan reacciones de oxidorreducción, en que átomos de oxigeno ó hidrogeno son trasladados entre moléculas: En las reacciones redox, siempre tienen que estar presentes a la vez el aceptor y el dador electrónico. AH2 + B A + BH2 Clasificación y nomenclatura Ared + Box Aox + Bred
- 30. Nombre: Dador:Aceptor oxidorreductasa Nombre común: Glucosa oxidasa b-D-Glucosa : O2 1-oxidorreductasa Dador Aceptor Clasificación y nomenclatura Grupo 1: Oxidorreductasas
- 32. Nomenclatura del subgrupo en oxidorreductasas: EC 1.1.x - Deshidrogenasas EC 1.2.x - Oxidasas EC 1.3.x - Peroxidasas EC 1.4.x - Oxigenasas EC 1.5.x - Hidroxilasas EC 1.6.x - Reductasas etc. Clasificación y nomenclatura Grupo 1: Oxidorreductasas
- 33. A-X + B A + B-X Grupo 2: Transferasas Catalizan reacciones de transferencia de átomos ó grupo de átomos entre moléculas: Dador: Aceptor Grupo transferido - transferasa ATP: D-Hexosa Fosfotransferasa EC 2.7.1.1 Nombre común: hexokinasa Clasificación y nomenclatura
- 35. Clasificación de subgrupo de las transferasas: EC 2.1.x - Grupos monocarbonados EC 2.2.x - Grupos aldehido o ceto EC 2.3.x - Aciltransferasas EC 2.4.x - Glicosiltransferasas EC 2.5.x - Alquil- o Ariltransferasas EC 2.6.x - Grupos nitrogenados EC 2.7.x - Grupos fosfato EC 2.8.x - Grupos sulfato EC 2.9.x - Grupos selenio Clasificación y nomenclatura Grupo 2: Transferasas
- 36. Grupo 3: Hidrolasas Catalizan incorporacion de agua (reacciones de hidrólisis) al sustrato o el desdoblamiento del sustrato por medio de agua. A-B + H2O A-OH + H-B Clasificación y nomenclatura
- 37. Clasificación de las hidrolasas: 3.1.-.- Esterasas (carboxilesterasas, fosfoesterasas, sulfoesterasas) 3.2.-.- Glicosidasas 3.3.-.- Éter hidrolasas 3.4.-.- Péptido hidrolasas 3.5.-.- Acil anhídrido hidrolasas etc. Grupo 3: Hidrolasas Clasificación y nomenclatura
- 38. REACCION DE LA GLUTAMINASA Glutamina Glutamato Glutaminasa NH4 + + + H2O Enzima Mitocondrial Desdoblamiento del sustrato por medio del agua
- 39. Fumarato + H2O Malato Fumarasa
- 40. caso particular Péptido hidrolasas: clasificación común (no sistemática) I. Según la situación del enlace atacado: - Exopeptidasas (extremos de la cadena) (Peptidasas) - Endopeptidasas (interior de la cadena) (Proteinasas) II. Según el mecanismo catalítico: - Serin proteinasas - Tiol proteinasas - Aspartil proteinasas - Metaloproteinasas Grupo 3: Hidrolasas Clasificación y nomenclatura
- 41. Grupo 4: Liasas Catalizan la unión o la ruptura de enlaces entre grupos de átomos del sustrato (este grupo no incluye las hidrolasas, oxidoreducción): A-B A + B Clasificación y nomenclatura Ejemplo Nombre sistemático: Histidina amonio-liasa (EC 4.3.1.3) Nombre común: Histidasa
- 42. Clasificación de las liasas: 4.1.x - Actúan sobre enlaces C-C 4.2.x - Actúan sobre enlaces C-O 4.3.x - Actúan sobre enlaces C-N 4.4.x - Actúan sobre enlaces C-S 4.5.x - Actúan sobre enlaces C-Haluro (S-, Cl-, Br-, I- At-) 4.6.x - Actúan sobre enlaces P-O 4.99.x - Otras liases Clasificación y nomenclatura Grupo 4: Liasas Descarboxilasas, deshidratasas, sintetasas, desaminas
- 43. Deshidratación de 2-fosfoglicerato para dar fosfoenolpiruvato: 2-fosfoglicerato deshidratasa
- 44. Grupo 5: Isomerasas Catalizan reacciones de isomerización moleculares (rearreglos intramoleculares) Reacciones altamente reversibles Nombres comunes: mutasa, epimerasa, aldo-ceto isomerasa Clasificación y nomenclatura A B Ejemplo: Glucosa isomerasa (EC 5.3.1.5)
- 46. 5.1.x - Rasemasas y Epimerasas 5.2.x - cis-Trans-Isomerasas 5.3.x - Oxidoreductasas Intramolecular 5.4.x - Transferasas Intramoleculares (mutases) 5.5.x - Liasas Intramoleculares 5.99.x - Otras Isomerasas Grupo 5: Isomerasas Clasificación y nomenclatura Clasificación de las isomerasas:
- 47. Grupo 6: Ligasas Catalizan la unión de dos grupos químicos a expensas de la hidrólisis de un nucleótido trifosfato (ATP, GTP, etc.). A + B + ATP A-B + ADP + Pi Clasificación y nomenclatura Ejemplo: Glutationa sintasa (EC 6.2.2.3) Nombre sistémico: G-L-glutamilo-L-cisteina:glicina ligase Pi
- 48. Grupo 6: Ligasas Clasificación y nomenclatura Clasificación de las ligasas: 6.1.x - Forman enlaces C-O 6.2.x - Forman enlaces C-S 6.3.x - Forman enlaces C-N 6.4.x - Forman enlaces C-C 6.5.x - Forman enlaces ésteres fosfóricos 6.6.x - Actúan sobre enlaces N-metal Nombres comunes: carboxilasa, tionasa, sintetasa
- 49. • Son precursores inactivos de enzimas. • Función: proteger la célula que los sintetiza. • EJEMPLOS: ▫ Pepsinógeno ▫ Tripsinógeno ▫ Quimiotripsinógeno ▫ Procolágeno ▫ …. PEPSINÓGENO Proenzima o zimógeno
- 50. Proenzima o zimógeno • Mecanismos de proteólisis • Algunas enzimas son sintetizadas y almacenadas como un precursor inactivo en un compartimiento celular, y se activan por otra enzima en el lugar o momento en que deben actuar. Ej:‡ Enzimas digestivas‡
- 51. ACTIVACIÓN DEL PEPSINÓGENO 1. Liberación del sitio autocatalítico por H+. 2. Autolisis de parte de la cadena 3. Pepsina (activa) 4. Pepsina activa otros pepsinógenos Caso de retroalimentación positiva
- 52. Tarea investigar que es: Holoenzima Grupo prostético
- 53. Cinética Enzimática La cinética enzimática es el análisis cuantitativo del efecto de cada uno de los factores que intervienen en la actividad enzimática, que se evalúa a través de la velocidad de la reacción catalizada. Variables que influyen en la velocidad de una reacción enzimática 1. Concentración de enzima 2. Concentración de substrato 3. pH 4. Temperatura 5. Efectores (Activadores e Inhibidores)
- 54. t s p [ ] Concepto de velocidad inicial
- 55. Efecto de la concentración de enzima: relación lineal v [E] . . .. . . . .. . .
- 56. S E ES P EP Ciclo catalítico de una enzima Una cinética lineal implica un proceso regenerativo, cíclico
- 57. v [s] Efecto de la concentración de substrato . . . . . . . .
- 58. E + S ES E + P k+1 k-1 k+2 Una cinética hiperbólica implica un proceso saturante: Hay un número limitado de sitios en la enzima para fijar substrato; una vez que están ocupados todos, por mucho que aumente la concentración de substrato, la velocidad permanecerá constante tendiendo a un valor asintótico Kcat (constante catalítica o número de recambio): número de moléculas de sustrato convertidas en producto por molécula de enzima, por unidad de tiempo.
- 59. Vm (velocidad máxima): es la velocidad alcanzada cuando todas las moléculas de E se encuentran unidas a S, para esto la [S] tiene que ser muy alta (saturación). Km (constante de Michaelis-Menten): es la [S] a la cual la enzima alcanza la mitad de su Vm (velocidad máxima) Km esta relacionado inversamente con la afinidad de la enzima por el sustrato.‡ la Vm es directamente proporcional a la cantidad total de enzima: Vm= Kcat x [E]total Kcat (constante catalítica o número de recambio): número de moléculas de sustrato convertidas en producto por molécula de enzima, por unidad de tiempo. v V s K s m max K E S ES es x e x s x m 0
- 60. Relación entre Km y Vmax Michaelis y Menten Concentración de Sustrato [S] Velocidad de la reacción (v) Km Vmax Vmax/2 La Km es la concentración de sustrato donde se obtiene la mitad de la Vmax v V s K s mx m
- 61. Concentración de Sustrato [S] Velocidad de la reacción (v) Km Vmax Vmax/2 A mayor Km, menor es la afinidad de la enzima por el sustrato A menor Km mayor es la afinidad de la enzima por el sustrato
- 64. La Tabla 7.3 muestra los valores de kcat/Km para diversos sustratos de la quimotripsina, una enzima digestiva secretada por el páncreas. Tiene preferencia a romper enlaces cerca de cadenas laterales hidrofóbicas y voluminosas
- 65. La mayoría de las reacciones bioquímicas incluyen múltiples sustratos Representación de Cleland para reacciones bisustrato. (A) Reacción secuencial. El primer sustrato (NADH) se une a la enzima y, después, se une el segundo sustrato (piruvato) para formar un complejo ternario compuesto por dos sustratos y la enzima. A continuación tiene lugar la catálisis, en la que se forma un complejo ternario compuesto por dos productos y la enzima. A continuación, se liberan los productos de forma secuencial. (B) Doble desplazamiento. Se une el primer sustrato (aspartato) y se produce el primer paso catalítico, con lo que se genera una enzima sustituida (E-NH3). A continuación, se libera el primer producto (oxalacetato). El segundo sustrato (a-cetoglutarato) se une a la enzima sustituida. Se produce el segundo paso catalítico en el que el NH3 se transfiere al sustrato para formar el producto final, glutamato, que se desprende de la enzima.
- 66. Factores que influyen en la velocidad de la reacción E-S • Concentración enzima: ▫ La velocidad de una reacion enzimatica es directamente proporcional a la concentración de la enzima. ▫ + [E]= +Vreacción • Concentración del sustrato: ▫ Aumento de concentración de sustrato, la velocidad aumenta hasta un maximo que representa la saturación de la enzima • Temperatura: ▫ Amento de la T°, la velocidad aumenta hasta una T° optima, después disminuye la velocidad de la reacción (desnaturalización) • pH: ▫ La velocidad de la reacción llega a un máximo para un pH optimo, adición de bases o ácidos desnaturalizar o inactivar la enzima y la velocidad disminuye.
- 67. Efecto de la temperatura en la ENZIMA Cada enzima tiene una temperatura óptima. Temperatura 15º 40º 75º Aumento de la velocidad Desnaturación por calor 1. Aceleración de la reacción según Arrhenius 2. Desnaturalización térmica de la proteína
- 68. Efecto del pH pH v 1. Sobre la fijación del substrato al centro activo: - Grupos disociables de la enzima - Grupos disociables del substrato 2. Sobre la transformación catalítica del substrato 3. Sobre la estructura de la proteína enzimática
- 69. ORGANISMOS TERMÓFILOS • Son organismos que viven a altas tº y realizan sus reacciones enzimáticas a estas altas tº • Ejemplos son los que viven en las aguas termales • Es tema de investigación el aislamiento de las enzimas de estos organismos para desarrollar procesos industriales en condiciones más extremas
- 70. Aspecto clínico Los cambios en la Km pueden tener consecuencias fisiológicas • La repercusión fisiológica de la Km se refleja en la sensibilidad de algunas personas hacia el etanol. • Ingerir pequeñas cantidades de alcohol, elevados efectos fisiológicos hígado síntomas En consecuencia, se convierte menos acetaldehído en acetato; el exceso de acetaldehído se escapa hacia la sangre y es responsable de los efectos fisiológicos. mayoría de la gente dos versiones de la aldehído deshidrogenasa Mitocondrial Km baja citoplasmática Km elevada personas susceptibles Km de la enzima citoplasmática es alta, sólo alcanza una velocidad catalítica elevada cuando la concentración de acetaldehído es muy alta.
- 72. Los inhibidores isostéricos pueden ser de dos tipos: 1. Inhibidor reversible: establece un equilibrio con la enzima libre, con el complejo enzima-substrato o con ambos: E + I EI 2. Inhibidor irreversible: modifica químicamente a la enzima: E + I E’ ES + I ESI
- 73. Inhibición reversible (a) El inhibidor se fija al centro activo de la enzima libre, impidiendo la fijación del substrato: Inhibición Competitiva (b) El inhibidor se fija a la enzima independientemente de que lo haga o no el substrato; el inhibidor, por tanto, no impide la fijación del substrato a la enzima, pero sí impide la acción catalítica: Inhibición No Competitiva (c) El inhibidor se fija únicamente al complejo enzima-substrato una vez formado, impidiendo la acción catalítica; este tipo se conoce como Inhibición Anticompetitiva
- 75. Inhibidores Competitivos • Compiten con el sustrato por el sitio activo de la enzima • Se une solo a la enzima libre • V máx no se altera y K M cambia
- 76. Inhibición competitiva Al aumentar la cantidad de SUSTRATO el inhibidor competitivo es desplazado y se forma producto
- 78. E ES EI I S E + P Características: - Las fijaciones de substrato e inhibidor son mutuamente exclusivas - A muy altas concentraciones de substrato desaparece la inhibición - Por lo general, el inhibidor competitivo es un análogo químico del substrato. - El inhibidor es tan específico como el substrato Se define una constante de equilibrio de disociación del inhibidor: Ki = [E] [I] [EI]
- 79. Km Sin inhibidor Km con inhibidor Sin inhibidor Con inhibidor El inhibidor competitivo aumenta la Km
- 80. Inhibidor competitivo su estructura es similar a la del sustrato No se forma producto Inhibidor competitivo Análogo estructural
- 81. • metabolismo de los nucleótidos para la síntesis de DNA • Metotrexato se usa en la terapia de algunos cánceres, inhibiendo la síntesis de DNA Metotrexato y Dihidrofolato
- 83. Inhibidor Incompetitivo En este tipo de inhibición el inhibidor se enlaza al centro activo pero solo después de que el sustrato lo haya hecho y, por tanto, inhibidor y sustrato no compiten. De esta manera, aunque todo el sustrato esté saturando la enzima y toda la enzima esté como complejo ES, el inhibidor puede enlazarse produciendo un complejo inactivo ESI. Como I solo se une a ES estimula la formación de ES y, por tanto, incrementa la unión del sustrato a la enzima, disminuyendo Km . Sin embargo, el complejo ESI no conduce a productos y Vm disminuye.
- 84. Inhibidor Incompetitivo • Se une a un lugar diferente del sitio activo de la enzima • Se une sólo al complejo enzima-sustrato • Los efectos que tiene: disminuye el valor de Km y también el de Vmáx
- 85. E ES S E + P I ESI Inhibición Anticompetitiva El inhibidor sólo puede fijarse al complejo ES; el complejo ESI no es productivo
- 87. Inhibidor No Competitivo • Se une a un lugar diferente del sitio activo la enzima • Se une a la enzima libre y también al complejo enzima-sustrato • Por acción del inhibidor disminuye la Vm pero el valor de Km no se altera
- 89. Inhibidor NO competitivo El inhibidor NO competitivo se une a la enzima en un sitio diferente del sitio activo
- 91. E ES EI I S E + P I ESI S Inhibición No Competitiva El inhibidor se fija indistintamente a la enzima libre E y al complejo enzima-substrato ES; ni el complejo EI ni el complejo ESI son productivos
- 92. Inhibición Irreversible - Los inhibidores irreversibles reaccionan con un grupo químico de la enzima, modificándola covalentemente - Su acción no se describe por una constante de equilibrio Ki, sino por una constante de velocidad ki: E + I E’ - A diferencia de la inhibición reversible, el efecto de los inhibidores irreversibles depende del tiempo de actuación del inhibidor. - Los inhibidores irreversibles son, por lo general, altamente tóxicos.
- 93. Inhibidores Irreversibles • Producen inactivación permanente de la actividad enzimática • Se interfiere con el normal desarrollo de una reacción o vía metabólica
- 94. Algunos tipos de inhibidores irreversibles 1. Reactivos de grupos -SH 2. Organofosfóricos 3. Ligandos de metales 4. Metales pesados
- 96. Enzimas Alostéricas • Son enzimas cuya estructura proteica está formada de varias subunidades • No se rigen por la cinética de M - M • Además del sitio o centro activo tienen sitios alostéricos o de regulación • Sitio activo/sustratos; • Sitio alostérico/moduladores o reguladores • La relación entre la velocidad de reacción y la concentración de sustrato sigue cinética sigmoídea
- 97. ENZIMAS ALOSTÉRICOS • Son proteínas: ▫ OLIGOMÉRICAS (con varias subunidades) ▫ Con centros reguladores: Para unión de un ACTIVADOR Para unión de un INHIBIDOR ▫ Y centro activo (en una o en varias subunidades) • Formas: ▫ R: forma activa (se forma product0) ▫ T: forma inactiva
- 99. • Las enzimas alostéricas presentan estructura cuaternaria. • Tienen diferentes sitios activos, unen mas de una molécula de sustrato • La unión del sustrato es cooperativa • la curva de velocidad presenta una forma sigmoidal ENZIMAS ALOSTÉRICOS
- 100. Concepto de Cooperatividad • La unión de los sustratos al sitio activo de una subunidad produce un cambio conformacional que por contacto físico se transmite a las subunidades vecinas, facilitando las interacciones • Modelos de unión: secuencial y concertado • Ejemplos: unión Hb-O2, enzimas alostéricas y sus sustratos
- 101. Moduladores Alostéricos • También reciben el nombre de efectores y pueden ser positivos o negativos • Se unen al sitio alostérico que puede estar en la misma subunidad que tiene al sitio activo o en las subunidades regulatorias • Su unión produce un cambio conformacional que afecta al sitio activo
- 104. Efector positivo Efector negativo Tiene subunidades catalíticas para los sustratos y subunidades regulatorias para los efectores