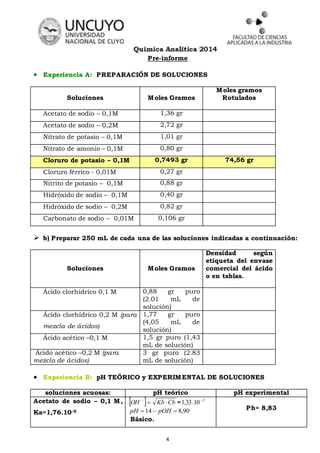
Este documento presenta las instrucciones para realizar un laboratorio sobre equilibrio ácido-base. Incluye preguntas de preparación sobre conceptos como la fortaleza de ácidos y bases y cálculo de pH. También describe 7 experiencias para medir el pH teórico y experimental de soluciones individuales de ácidos y bases, mezclas de ácidos y bases, y calcular constantes de acididad y basicidad. El objetivo es comprender experimentalmente los conceptos de equilibrio ácido-base a través de la medición y cálculo de pH en diferentes sistemas




![ Experiencia E: pH TEÓRICO y EXPERIMENTAL DE UNA MEZCLA DE ÁCIDOS
MEZCLA DE ÁCIDOS pH
6
TEÓRICO
pH
EXPERIMENTAL
vaso 1 : colocar 50 mL de ácido clorhídrico 0,1 M 1 1,36
vaso 2 : colocar 50 mL de ácido acético 0,1 M 2,90 2,92
vaso 3 : colocar 50 mL de ácido clorhídrico 0,2 M
0.99 1
+ 50 mL de ácido acético 0,2 M
vaso 4 : colocar 50 mL de ácido clorhídrico 0,2 M
+ 50 mL de agua destilada
2 1
pH teórico
Vaso 1: Acido Clorhídrico 0,1 M
H
HCl
log log0,11
pH HCl
Vaso2: Acido acético 0,1 M
10 *0,1 10 log(10 2,9 4.8 2.9 2.9) H pH
Vaso 3: Colocar 50 mL de ácido clorhídrico 0,2 M + 50 mL de ácido acético 0,2 M
; 0,2 0.69 2 3 3 HCl H O Cl H O H O M pH
CH COO H O
3 3 1,8.10
5
2
3
0,2
x
x
CH COOH
Ka
2 5 6 6 3 0,2*1,8.10 9.10 9.10 1,89*10 x x log( pH 3 1,89 *10 )=2,72
Como en la disolución de ácido acético la concentración de iones hidronios es
5 1,8.10 , para que la disolución de ácido clorhídrico tenga el mismo pH, es necesario
que la [HCl] sea igual a 5 1,8.10 .
Vaso 4: colocar 50 mL de ácido clorhídrico 0,2 M + 50 mL de agua destilada
El agua destilada tiene carácter neutro, el pH inicial será 7, ya que
7
3 10 H O OH ](https://image.slidesharecdn.com/informedelab2-140911101336-phpapp01/85/Equilibrio-Acido-Base-6-320.jpg)
![mL moles
, mientras que: log log(0,01) 2 3 pH H O
7
1) Si se añade 50 mL de HCl 0,2 M.
El HCl es un ácido fuerte, totalmente disociado, luego la cantidad de protones
liberados será la misma que de ácido inicial:
En 1L = 1.000 mL de HCl 0,2 M, habrá 0,2 moles de ácido, en 50 ml habrá:
moles
50 *0,2
mL
0,01
1.000
El volumen final es 50 mL de agua + 50 ml de ácido= 100 mL, la concentración
molar de protones será:
3
H O = 10 H O 0,01
M
3 3
L
0,1
Es, por tanto, una disolución fuertemente ácida.
Experiencia F: pH TEÓRICO y EXPERIMENTAL DE UNA MEZCLA DE BASES
MEZCLA DE BASES
pH
TEÓRICO
pH
EXPERIMENTAL
vaso 1 : colocar 50 mL de hidróxido de sodio 0,1 M 13 12,58
vaso 2 : colocar 50 mL de acetato de sodio 0,1 M 8,9 8,83
vaso 3 : colocar 50 mL de hidróxido de sodio 0,2 M +
50 mL de acetato de sodio 0,2 M
13,000034 12,58
vaso 4 : de hidróxido de sodio 0,2 M y adicionar 50 mL
de agua destilada
13 12,59
b) pH teórico
Vaso 1: colocar 50 mL de hidróxido de sodio 0,1 M
pOH= - log[OH-]= -log[0,1]=1 pH=14-pOH=14-1= 13.
Vaso 2: colocar 50 mL de acetato de sodio 0,1 M
6 7.45.10 OH
6 log 7.45.10 pOH = 5.12
pH 14 pOH 14 5,12 8.88](https://image.slidesharecdn.com/informedelab2-140911101336-phpapp01/85/Equilibrio-Acido-Base-7-320.jpg)
![Vaso 3: 50 mL de hidróxido de sodio 0,2 M + 50 mL de acetato de sodio 0,2 M
NaOH NaCH COOH 2Na CH COO 2OH 3 3
0,2
8
[OH-]=Cb=0,2M
pOH=0,69 pH=14-0,69=13,31.
Vaso 4: colocar 50 mL de hidróxido de sodio 0,2 M y adicionar 50 mL de agua
destilada.
El H2O es neutra, por lo tanto su pH=7
Si se añaden 50 mL de NaOH 0,2 M a 50 mL de H2O, la concentración de la
disolución resultante es:
M
molNaOH
mLNaOH M
mLNaOH M
50 *0,2
mLdisolución
0,1
1 0,2
*
100
El NaOH, es una base fuerte que se encuentra completamente disociada en iones de
acuerdo a la ecuación
pOH=-log(0,1)=1
ph= pOH-pH=14-1= 13
Conclusiones generales.
Los valores de pH teóricos y experimentales se asemejan, esto es debido a la
precisión que se obtuvo al realizar las soluciones pedidas.
El error humano (error al pesar los gramos pedidos, al enrasar, al tomar
medidas desde los peachímetros)
Mala calibración de los peachímetros.
Impurezas del agua del agua destilada así también como en las
soluciones, ya que podrían estar contaminados.](https://image.slidesharecdn.com/informedelab2-140911101336-phpapp01/85/Equilibrio-Acido-Base-8-320.jpg)