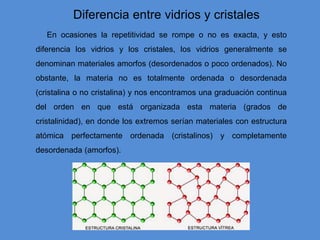
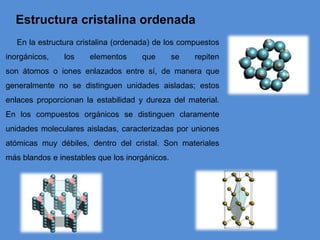
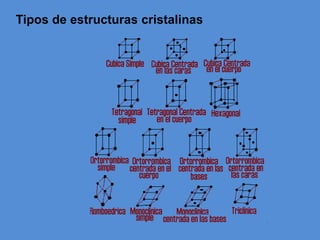
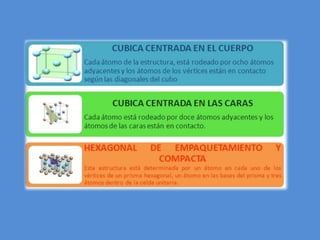
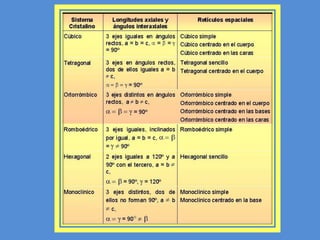
El documento describe la estructura atómica y cristalina. Explica que los átomos están compuestos de un núcleo central con carga positiva rodeado por electrones. Los modelos atómicos han evolucionado para reflejar mejor las propiedades ondulatorias de los electrones. La estructura cristalina se refiere al ordenamiento de los átomos en patrones que se repiten en 3D, dando lugar a materiales puros y homogéneos.