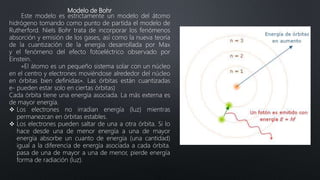
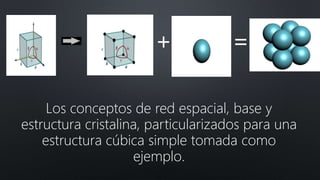
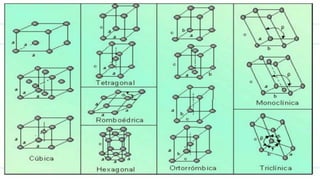
El documento resume la evolución del concepto de átomo a través de los modelos de Dalton, Thomson, Rutherford y Bohr. Explica que Dalton propuso que la materia estaba compuesta de partículas indivisibles llamadas átomos, mientras que posteriores modelos incorporaron el descubrimiento del electrón y propusieron que los átomos consisten en un núcleo central positivo con electrones orbitando alrededor.