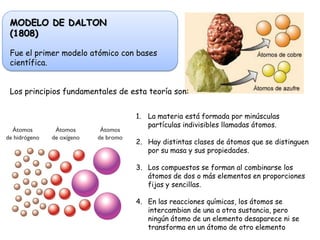
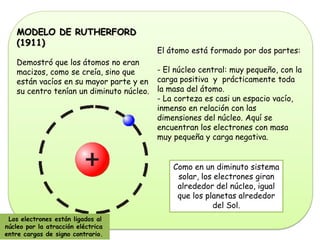
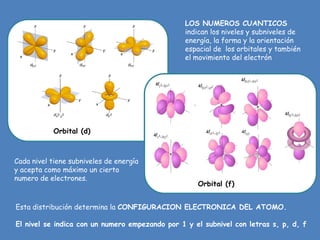
El documento describe la historia y evolución de los modelos atómicos, desde la antigua Grecia hasta el modelo atómico actual. Explica que los átomos son las partículas más pequeñas de la materia y no pueden dividirse más. Los modelos incluyen las ideas de Demócrito y Leucipo, Dalton, Thomson, Rutherford, Bohr y el modelo actual basado en los números cuánticos y la mecánica cuántica.