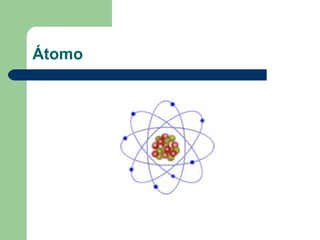
La materia está compuesta de átomos, las unidades más pequeñas de los elementos químicos. Los átomos contienen protones y neutrones en el núcleo y electrones en la corteza. Las moléculas son conjuntos de átomos unidos entre sí que muestran las propiedades químicas de una sustancia. Las moléculas pueden contener átomos del mismo elemento o de diferentes elementos.