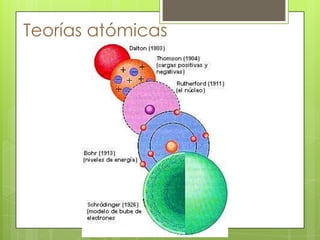
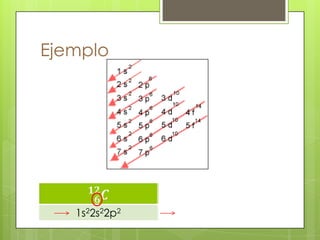
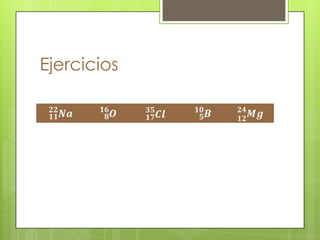
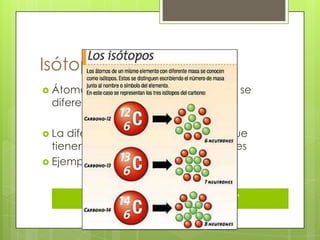
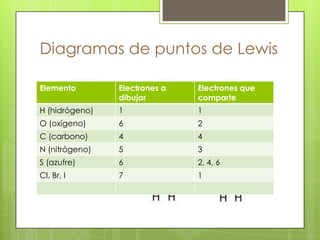
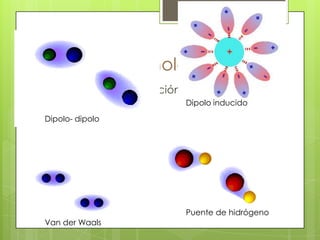
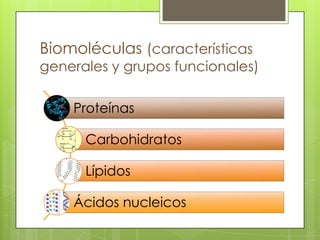
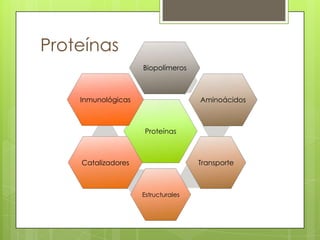
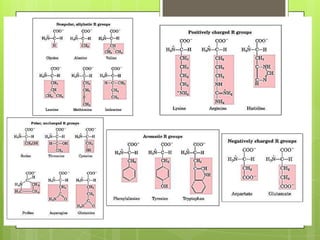
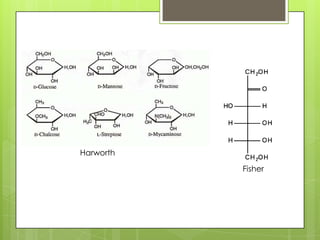
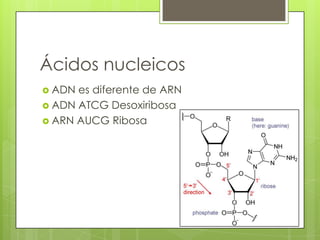
Este documento presenta información sobre átomos, moléculas y vida. Explica las teorías atómicas, distribución electrónica, iones, fuerzas intermoleculares, agua, macronutrientes, características químicas de biomoléculas como proteínas, carbohidratos y ácidos nucleicos. También cubre temas como isótopos, electrones de valencia, diagramas de Lewis, grupos funcionales orgánicos e identificación de biomoléculas.