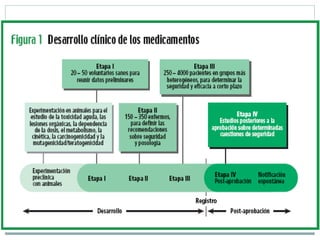
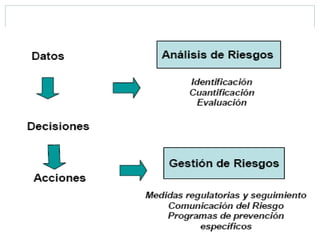
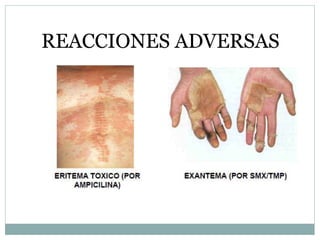
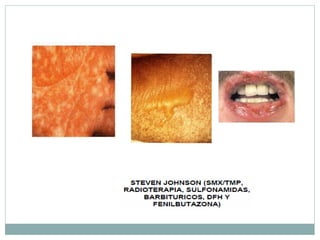
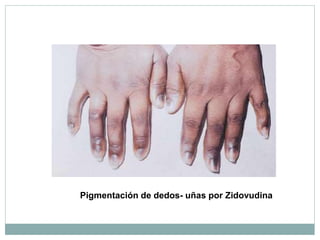
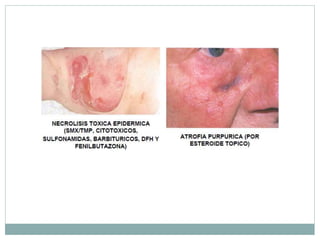
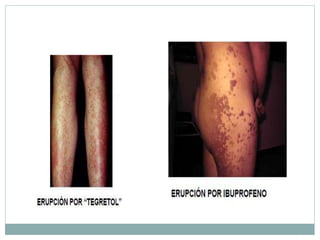
Este documento trata sobre farmacovigilancia y reporte de reacciones adversas a medicamentos. Explica que la farmacovigilancia involucra la detección, evaluación y prevención de efectos adversos de medicamentos una vez comercializados. También clasifica las reacciones adversas en tipos A, B, C, D, E y F dependiendo de su relación con la dosis del medicamento y el tiempo de aparición. Finalmente, describe los procesos de identificación, cuantificación, evaluación y gestión del riesgo asociado al uso de