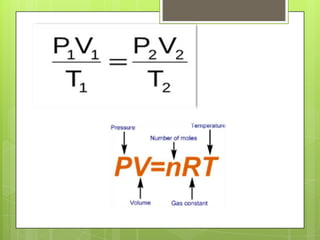
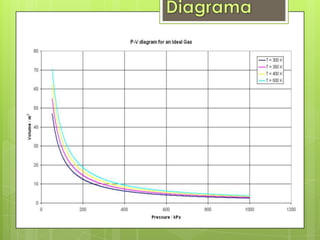
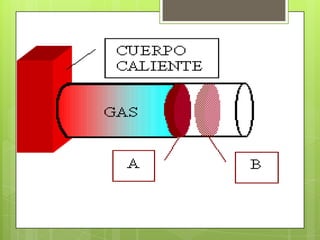
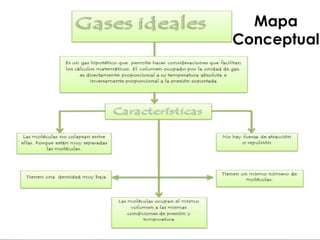
Este documento describe los gases ideales. Explica que un gas ideal es aquel que cumple estrictamente con las leyes de Boyle, Charles y Avogadro. Sus moléculas se mueven al azar sin fuerzas entre ellas excepto durante las colisiones. La ecuación de los gases ideales establece que la presión y el volumen de un gas son directamente proporcionales a la cantidad de moles y la temperatura absoluta del gas.