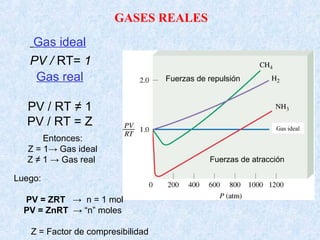
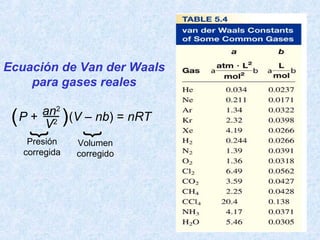
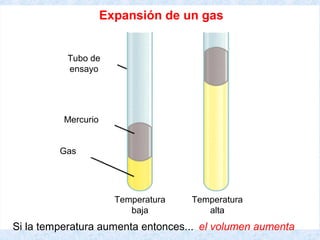
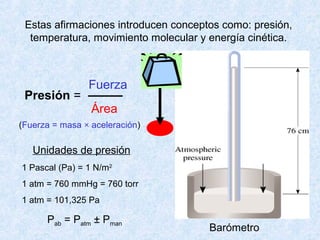
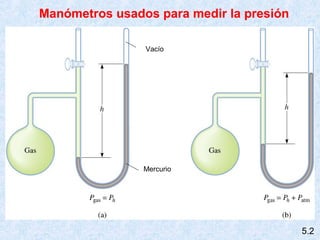
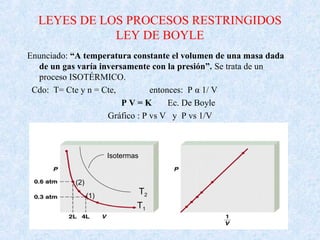
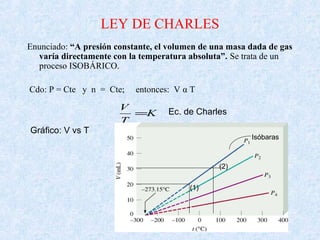
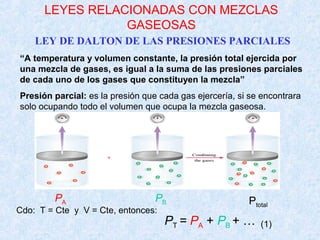
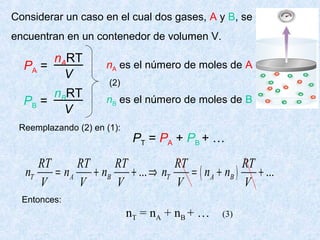
Este documento trata sobre los gases y sus propiedades físicas. Explica que los gases pueden adoptar cualquier forma, son compresibles y se expanden fácilmente. Además, presenta las leyes de Boyle, Charles y Gay-Lussac, las cuales describen la relación entre la presión, volumen y temperatura de los gases ideales. Finalmente, introduce la ecuación de estado de los gases ideales.

























![HUMEDAD RELATIVA: Hr
Es el contenido de vapor de agua que contiene el gas.
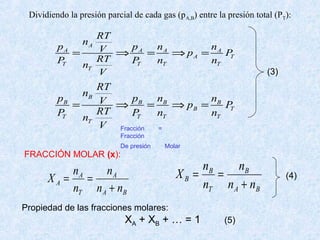
%100%
2
2
×=
OvH
OH
P
p
Hr
pH2O = Presión parcial del agua gaseosa
PvH2O = Presión de vapor o tensión de vapor del agua en equilibrio con
su líquido (tablas)
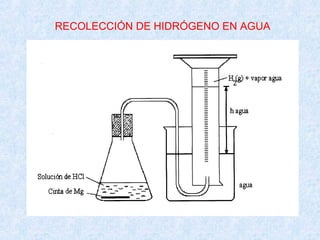
¿Cuántos miligramos de vapor de agua contiene un frasco de 2L lleno
de aire al 70% de humedad y a 25ºC?. Si PvH2O (25ºC) = 23,76 mm Hg.
SOLUCIÓN
m= ? H2O
V = 2 L
%Hr = 70%
T = 25ºC + 273 = 298 K
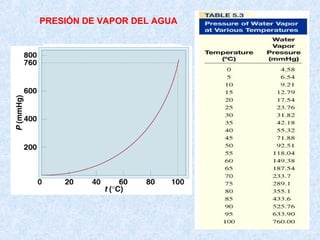
PvH2O (25ºC) = 23,76 mm Hg
Por fórmula: %Hr= (pH2O / PvH2O) x 100%
70% = (pH2O / 23,76 mmHg) x 100%
pH2O = 16,6 mmHg
Cálculo del V:
PVM = mRT, entonces : m = (MPV)/
RTm = [18 g/mol x 16,6 mmHg x 2 L] / [62,4 (mmHg x L / mol x K) x 298 K]
m = 0,03213 g = 32,13 mg](https://image.slidesharecdn.com/gasesideales-140729124136-phpapp01/85/Gases-ideales-37-320.jpg)