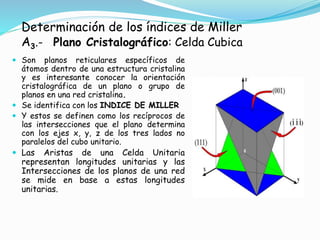
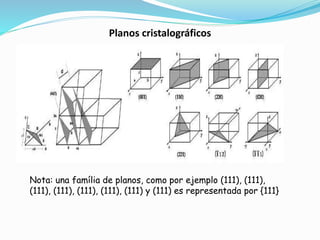
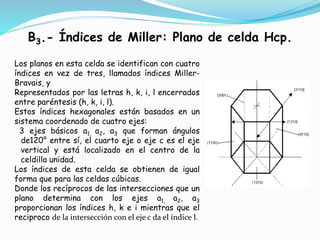
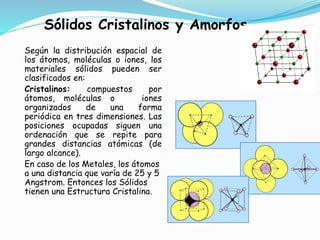
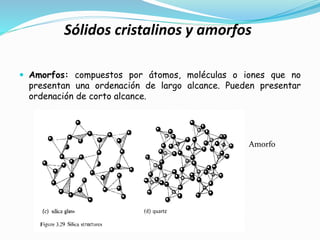
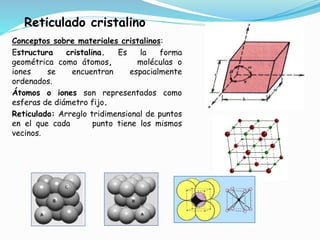
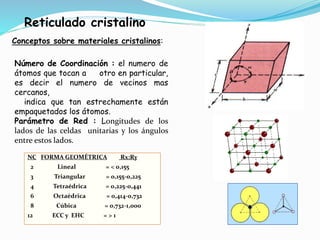
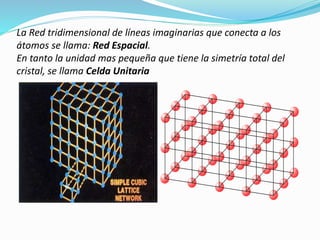
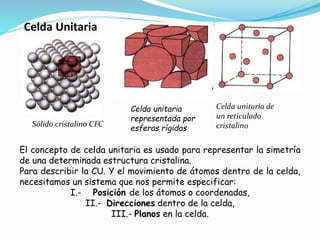
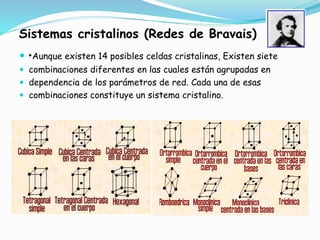
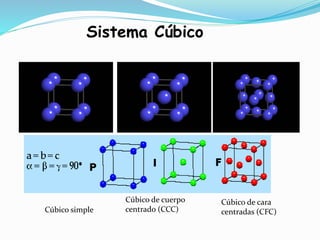
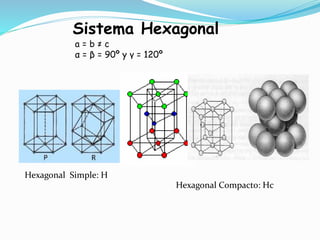
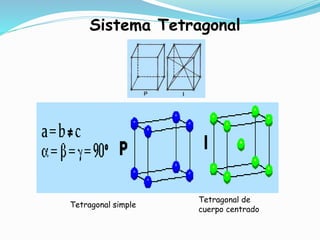
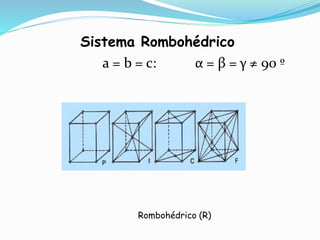
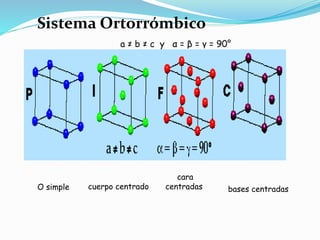
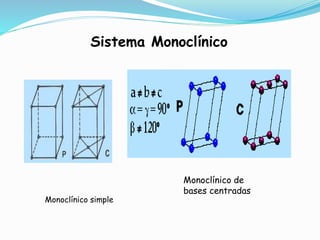
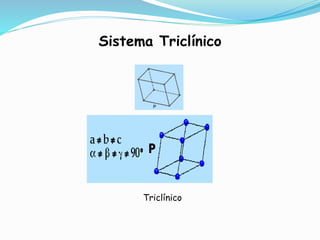
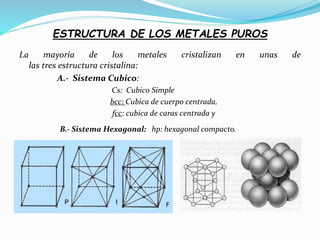
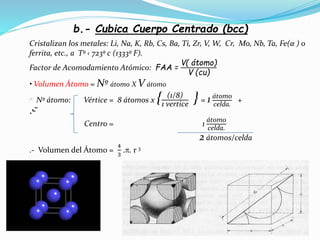
El documento describe conceptos fundamentales sobre estructuras cristalinas de materiales. Explica que los materiales sólidos pueden ser cristalinos u amorfos dependiendo del ordenamiento de los átomos que los componen. Los materiales cristalinos se caracterizan por tener una estructura cristalina donde los átomos se ordenan de forma periódica en tres dimensiones. También define conceptos como celda unitaria, sistemas cristalinos, índices de Miller y las principales estructuras cristalinas de los metales puros como cúbica simple














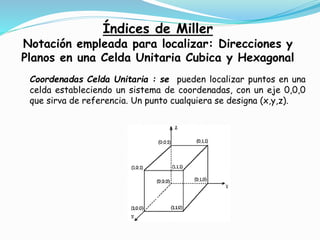
![Índices de Miller:
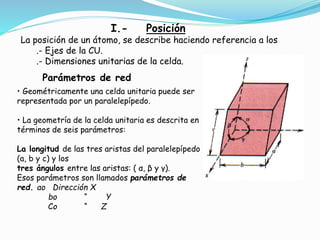
II.- Direcciones Cristalográficas
Dirección cristalográfica: vector que une dos puntos de la red
cristalina.
Procedimiento para determinación de los índices de Miller de una
Dirección Cristalográfica:
Trasladar el “vector dirección” de manera que pase por el
origen del sistema de coordenadas.
Determinar la proyección del vector en cada uno de los tres
ejes coordenados. Esas proyecciones deben ser medidas en
términos de los parámetros de red (a,b,c)
Multiplicar o dividir esos tres números por un factor común,
de tal forma tal que los tres números resultantes sean los
menores enteros posibles.
Representar la dirección escribiendo los tres números entre
corchetes: [u v w].](https://image.slidesharecdn.com/clase-cristalografia-170525013649/85/Clase-cristalografia-36-320.jpg)
![Direcciones Cristalográficas de un CUBO: Ejemplo
Nota: una familia de direcciones, por ejemplo [100], [100],
[010], [010], [001] y [001] es representada por <100>
X Y Z
Proyecciones en
Termino a. b y c
½ x a 1 x b 0 x c
Proyecciones 1/2 1 0
Reducción a
Mínimos Enteros
1 2 0
Notación [120]](https://image.slidesharecdn.com/clase-cristalografia-170525013649/85/Clase-cristalografia-37-320.jpg)