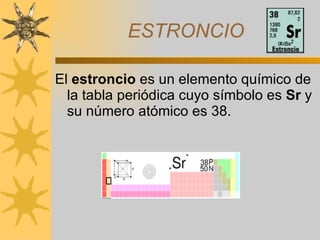
1) Los documentos describen los elementos químicos berilio, magnesio, calcio y estroncio, que son metales alcalinotérreos.
2) Se proporciona información sobre sus propiedades físicas y químicas, así como sobre sus efectos en la salud y el medio ambiente.
3) Además, se incluye breve historia sobre su descubrimiento y obtención comercial.


![El berilio tiene uno de los puntos de fusión más altos entre los metales ligeros. En condiciones normales de presión y temperatura el berilio resiste la oxidación del aire, aunque la propiedad de rayar al cristal se debe probablemente a la formación de un delgada capa de óxido. General Nombre, símbolo, número Berilio, Be, 4 Serie química Metales alcalinotérreos Grupo, periodo, bloque 2, 2 , s Densidad, dureza Mohs 1848 kg/m³ , 5,5 Propiedades atómicas Masa atómica 9,012182(3) u Radio medio † 112 pm Radio atómico calculado 111,3 pm Radio covalente 89 pm Radio de Van der Waals sin datos Configuración electrónica [ He ]2 s ² Estados de oxidación (óxido) 2 (anfótero) Estructura cristalina Hexagonal Propiedades físicas Estado de la materia sólido (diamagnético) Punto de fusión 1551,15 K Punto de ebullición 3243,15 K Entalpía de vaporización 292,40 kJ/mol Entalpía de fusión 12,20 kJ/mol Presión de vapor 4180 Pa Velocidad del sonido 13000 m/s](https://image.slidesharecdn.com/grupo-2-1213316368262667-9/85/Grupo-2-3-320.jpg)










![APLICACIONES El uso principal del metal es como elemento de aleación del aluminio, empleándose las aleaciones aluminio-magnesio en envases de bebidas. El hidróxido (leche de magnesia), el cloruro, el sulfato (sales Epsom) y el citrato se emplean en medicina. El polvo de carbonato de magnesio (MgCO3) es utilizado por los atletas como gimnastas y levantadores de peso para mejorar el agarre de los objetos. Otros usos incluyen flashes fotográficos, pirotecnia y bombas incendiarias. USOS Es utilizado para tratar problemas digestivos asociados al tránsito intestinal, como el de colon irritable. Este es el caso de algunas estaciones termales (como la de Châtelguyon[1] ) con aguas muy ricas en magnesio y que proponen tratamientos digestivos, urinarios y anti-estrés. Contra el Blefaroespasmo tomado como suplemento de Cloruro de Magnesio resulta ser efectivo en algunos casos.](https://image.slidesharecdn.com/grupo-2-1213316368262667-9/85/Grupo-2-14-320.jpg)