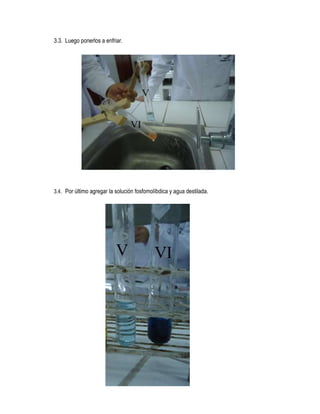
Este documento presenta información sobre una práctica de laboratorio realizada por estudiantes de
odontología sobre la actividad enzimática de la alfa-amilasa. La práctica midió la degradación del
almidón catalizada por la alfa-amilasa en la saliva mediante reacciones y cambios de color. Los
estudiantes analizaron cómo factores como la temperatura y el pH afectan la actividad enzimática.
El objetivo era demostrar experimentalmente la capacidad de la alfa-amilasa para degradar el
almidón en maltosa